
 某溫度時,在2L密閉容器中,X、Y、Z三種物質的物質的量隨時間變化的曲線如圖所示.由圖中數據分析:
某溫度時,在2L密閉容器中,X、Y、Z三種物質的物質的量隨時間變化的曲線如圖所示.由圖中數據分析:分析 (1)根據參加反應的物質的物質的量之比等于化學計量數之比書寫化學方程式;
(2)根據化學反應速率v=$\frac{△c}{△t}$進行計算;
(3)Z的轉化率=$\frac{Z的物質的量變化}{Z的初始物質的量}$×100%;
(4)從曲線的變化特點分析.
解答 解:(1)由圖象可以看出,反應中Z、Y的物質的量減少,應為反應物,X的物質的量增多,應為生成物,
當反應進行到3min時,△n(Y)=0.8mol-0.6mol=0.2mol,△n(Z)=1.6mol-1.2mol=0.4mol,△n(X)=0.6mol,
則△n(Y):△n(Z):△n(X)=1:2:3,參加反應的物質的物質的量之比等于化學計量數之比,則該反應的化學方程式為:Y+2Z?3X,
故答案為:Y+2Z?3X;
(2)反應開始至2min末,X的反應速率為:v=$\frac{△c}{△t}$=$\frac{\frac{0.6mol}{2L}}{3min}$=0.1mol/(L•min),
故答案為:0.1mol/(L•min);
(3)根據圖象可知,平衡時Z的物質的量變化為:△n(Z)=1.6mol-1.2mol=0.4mol,則Z的轉化率為:$\frac{0.4mol}{1.6mol}$×100%=25%,
故答案為:25%;
(4)3min后,各物質的物質的量不再發生變化,說明該反應已經達到反應限度,
故答案為:在此條件下該反應已達到反應限度(或化學平衡).
點評 本題考查了化學平衡的計算,題目難度中等,明確化學平衡的特征為解答關鍵,注意掌握化學反應速率的概念及表達式,試題培養了學生的化學計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 由非電解質溶于水得到的溶液 | |
| B. | [H+]、[OH-]均為5.0×10-7mol•L-1的溶液 | |
| C. | 等物質的量的強酸與強堿反應得到的溶液 | |
| D. | 將pH=9的燒堿溶液稀釋100倍所得到的溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
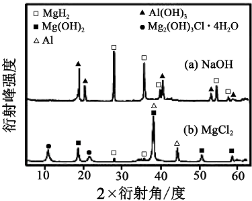
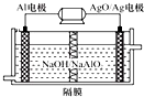
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該電池放電時,正極的電極反應為O2+4H++4e-═2H2O | |
| B. | 該電池充電時,陰極發生了氧化反應:Li++e-═Li | |
| C. | 電池中的有機電解液可以用稀鹽酸代替 | |
| D. | 正極區產生的LiOH可回收利用 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
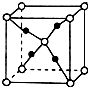 X、Y、Z、R是元素周期表中前四周期中的常見元素.X的單質是密度最小的氣體;Y的一種核素常用于考古,且其一種同素異形體是較軟的物質之一;Z的氣態氫化物與其最高價氧化物的水化物相遇會產生大量白煙;R2+離子的3d軌道有9個電子.(答題時用具體的元素符號)
X、Y、Z、R是元素周期表中前四周期中的常見元素.X的單質是密度最小的氣體;Y的一種核素常用于考古,且其一種同素異形體是較軟的物質之一;Z的氣態氫化物與其最高價氧化物的水化物相遇會產生大量白煙;R2+離子的3d軌道有9個電子.(答題時用具體的元素符號)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氧化鈉溶于水只發生擴散作用 | |
| B. | 氫氧化鈉溶于水只發生水合作用 | |
| C. | 氫氧化鈉溶于水擴散過程吸收熱量大于水合過程放出的熱量 | |
| D. | 氫氧化鈉溶于水擴散過程吸收熱量小于水合過程放出的熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
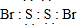 ;
;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com