
| A. | 同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點燃條件下的△H相同 | |
| B. | 任何酸與堿發生中和反應生成1 mol H2O的過程中,能量變化均相同 | |
| C. | 已知:①2H2(g)+O2(g)═2H2O(g)△H1②2H2(g)+O2(g)=2H2O(1)△H2,則△H1<△2 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,②C(s,金剛石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1 則C(s,石墨)=C(s,金剛石)△H=-1.5 kJ•mol-1 |
分析 A.反應的熱效應只與始態、終態有關,與過程無關;
B.依據中和熱概念分析可知,只有強酸和強堿的稀溶液中和生成1mol水時且無沉淀生成,放出的熱量才相同;
C.△H=Q(生成物能量和)-Q(反應物能量和),水蒸氣比液體水能量高;
D.依據熱化學方程式和蓋斯定律計算①-②的結果分析判斷.
解答 解:A.反應的熱效應只與始態、終態有關,與過程無關,所以同溫同壓下,H2(g)+Cl2(g)=2HCl(g)在光照和點燃條件下的△H相同,故A正確;
B.弱酸弱堿沒有完全電離,電離時需吸收能量,中和生成1mol水時放出的熱量少,強酸強堿稀溶液反應生成1mol水同時生成沉淀,放出熱量會增大,故B錯誤;
C.△H=Q(生成物能量和)-Q(反應物能量和),水蒸氣比液體水能量高,所以生成液態水放出的熱量多,焓變為負值,則△H1>△H2,故C錯誤;
D.①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,②C(s,金剛石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1,蓋斯定律計算①-②得到,C(s,石墨)=C(s,金剛石)△H=+1.5 kJ•mol-1,故D錯誤;
故選A.
點評 本題考查化學反應中能量的變化以及焓變的意義,蓋斯定律計算和中和熱概念實質理解,難度不大,注意基礎知識的積累.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3溶液能與石灰水反應,而NaHCO3溶液不能與石灰水反應 | |
| B. | NaHCO3俗稱小蘇打,Na2CO3俗稱蘇打或純堿 | |
| C. | Na2CO3很穩定,而NaHCO3受熱時容易分解 | |
| D. | 將等物質的量的NaHCO3粉末與Na2CO3粉末同時分別倒入適量的相同濃度的稀鹽酸中,前者的反應更劇烈 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,11.2L CO2與8.5g NH3所含分子數相等 | |
| B. | 等質量的H3O+和OH-質子數之比與電子數之比相同 | |
| C. | 同溫同壓下,相同體積的H2和CO2的原子數之比為2:3 | |
| D. | 同溫同壓下,相同質量的NO和C2H4(氣體)體積相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
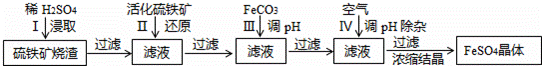
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用酒精萃取碘水中的碘 | |
| B. | 分液時,把上層液體從分液漏斗上口倒出 | |
| C. | 不慎灑出的少量酒精在桌上著火時,立即用濕布蓋滅 | |
| D. | 配制1.00mol/LNaCl溶液時,將稱好的NaCl固體放入燒杯中溶解 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化劑和還原劑都是KMnO4 | |
| B. | 該反應的還原產物只有MnO2 | |
| C. | 該反應的氧化產物是O2 | |
| D. | KMnO4中Mn元素表現氧化性,O元素表現還原性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.0 | B. | 12.3 | C. | 1.7 | D. | 12.0 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com