
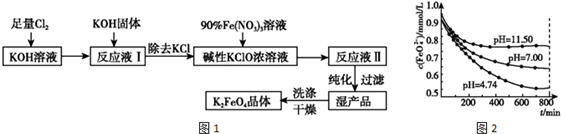
分析 (1)根據題中提示可知,低溫和高溫產物不同主要區別是生成KClO還是KClO3,而制備原理為:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O;
(2)反應中Fe元素化合價由+3價升高為+6價,共升高3價,Cl元素化合價由+1價降低為-1,價,共降低2價,化合價升降最小公倍數為6,則Fe(NO3)3的系數為2、NaClO的系數為3,再根據原子守恒配平;(3)氯氣與氫氧化鈉溶液反應后會溶解未反應的氯氣,再加入氫氧化鈉固體,繼續反應生成NaClO,且氫氧化鈉在制備高鐵酸鉀中參加反應;
(4)由方程式可得關系式:3Cl2~3KClO~2K2FeO4,根據關系式計算;
(5)OH-濃度大,使FeO4-+10H2O?4Fe(OH)3+8OH-+3O2↑平衡向左移動.
解答 解:(1)根據題中提示可知,氯氣與氫氧化鈉的反應中,低溫和高溫產物不同主要區別是生成KClO還是KClO3,而制備原理為:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O,故應在溫度較低的情況進行,
故答案為:溫度較低;
(2)反應中Fe元素化合價由+3價升高為+6價,共升高3價,Cl元素化合價由+1價降低為-1,價,共降低2價,化合價升降最小公倍數為6,則Fe(NO3)3的系數為2、NaClO的系數為3,再根據原子守恒配平后方程式為:2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O,
故答案為:2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O;
(3)氯氣與氫氧化鈉溶液反應后會溶解未反應的氯氣,再加入氫氧化鈉固體,與過量的Cl2繼續反應,生成更多的KClO,且氫氧化鈉在制備高鐵酸鉀中參加反應,為下一步反應提供反應物,
故選:AC;
(4)3Cl2~3KClO~2K2FeO4
3×22.4 L 198g×2
V(Cl2) mg
所以V(Cl2)=$\frac{67.2L×mg}{198g×2}$=$\frac{5.6m}{33}$ L
故答案為:$\frac{5.6m}{33}$;
(5)在pH=11.50的溶液中,OH-濃度大,使FeO4-+10H2O?4Fe(OH)3+8OH-+3O2↑平衡向左移動,高鐵酸鉀的最終濃度比pH=4.74的溶液中高,
故答案為:在pH=11.50的溶液中,OH-濃度大,使FeO4-+10H2O?4Fe(OH)3+8OH-+3O2↑平衡向左移動.
點評 本題考查物質制備工藝流程,側重考查閱讀題目獲取信息的能力、對工藝流程的理解與條件的選擇控制,難度中等,需要學生具有扎實的基礎知識與靈活運用知識解決問題的能力.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
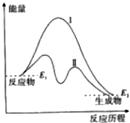
| A. | 曲線Ⅰ和曲線Ⅱ分別表示兩個化學反應的能量變化 | |
| B. | 曲線Ⅱ可表示反應2NH3$?_{高溫高壓}^{催化劑}$N2+3H2的能量變化 | |
| C. | 該反應不需要加熱就能發生 | |
| D. | 該反應的△H=E2-E1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
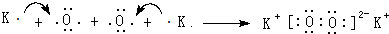 (用元素符號表示).
(用元素符號表示).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一個可逆反應達到的平衡狀態就是這個反應在該條件下所能達到的限度 | |
| B. | 增大反應物濃度,能增大活化分子百分數,所以反應速率增大 | |
| C. | 在化學反應過程中,發生物質變化的同時不一定發生能量變化 | |
| D. | 100 mL 2 mol/L的鹽酸跟鋅片反應,加入適量的氯化鈉溶液,反應速率不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
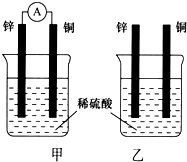 分別按下圖甲、乙所示裝置進行實驗,圖中兩個燒杯里的溶液為同濃度的稀硫酸,甲中A為電流表.請回答下列問題:
分別按下圖甲、乙所示裝置進行實驗,圖中兩個燒杯里的溶液為同濃度的稀硫酸,甲中A為電流表.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
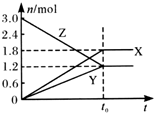 在一定溫度下,將一定量的氣體通入體積為2 L的密閉容器中,使其發生反應,有關物質X、Y、Z的物質的量的變化如圖所示.則下列有關推斷正確的是( )
在一定溫度下,將一定量的氣體通入體積為2 L的密閉容器中,使其發生反應,有關物質X、Y、Z的物質的量的變化如圖所示.則下列有關推斷正確的是( )| A. | 該反應的化學方程式為:3Z═3X+2Y | B. | t0時,X、Y、Z的質量不再改變 | ||
| C. | t0時,Z的濃度為1.2 mol/L | D. | t0時,反應停止,反應速率為0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
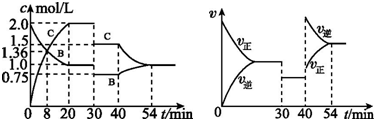
| A. | 30 min~40 min 間該反應使用了催化劑 | |
| B. | 反應方程式中的x=2,正反應為吸熱反應 | |
| C. | 30 min 時條件的變化是降低壓強,40 min 時條件的變化是升高溫度 | |
| D. | 前8 min A 的平均反應速率為0.08 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 苯氧乙酸甲酯的分子式為C9H10O3 | |
| B. | 苯氧乙酸與鄰羥基苯乙酸不互為同分異構體 | |
| C. | 苯酚和鄰羥基苯乙酸可用FeCl3溶液檢驗 | |
| D. | ClCH2COOH與足量燒堿溶液共熱所得有機物為HOCH2COOH |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com