
 ;
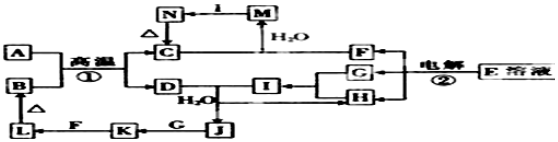
;分析 L為紅褐色沉淀,則L為Fe(OH)3,Fe(OH)3受熱分解生成B為Fe2O3,A、D是金屬單質,A與B在高溫下反應生成D,則該反應為鋁熱反應,所以A為Al,C為Al2O3,D為Fe,E為食鹽的主要成分,則E為NaCl,電解E得F、G、H分別為NaOH、H2、Cl2,G、H反應生成I,I的水溶液呈強酸性,則F為NaOH,所以I為HCl,D和I反應生成H和J,則H為H2,J為FeCl2,所以G為Cl2,J與G反應生成K為FeCl3,C和F反應生成M為NaAlO2,M與I生成N,N受熱分解得C,則N為Al(OH)3,據此答題.
解答 解:L為紅褐色沉淀,則L為Fe(OH)3,Fe(OH)3受熱分解生成B為Fe2O3,A、D是金屬單質,A與B在高溫下反應生成D,則該反應為鋁熱反應,所以A為Al,C為Al2O3,D為Fe,E為食鹽的主要成分,則E為NaCl,電解E得F、G、H分別為NaOH、H2、Cl2,G、H反應生成I,I的水溶液呈強酸性,則F為NaOH,所以I為HCl,D和I反應生成H和J,則H為H2,J為FeCl2,所以G為Cl2,J與G反應生成K為FeCl3,C和F反應生成M為NaAlO2,M與I生成N,N受熱分解得C,則N為Al(OH)3,
(1)HCl為共價化合物,氫原子和氯原子間形成一對共用電子對,電子式為: ,故答案為:
,故答案為: ;
;
(2)反應①為鋁熱反應,反應的化學方程式為2Al+Fe2O3$\frac{\underline{\;高溫\;}}{\;}$2Fe+Al2O3,
故答案為:2Al+Fe2O3$\frac{\underline{\;高溫\;}}{\;}$2Fe+Al2O3;
(3)向M為NaAlO2溶液中加入過量的I為HCl溶液反應的離子方程式為:AlO2-+4H+=Al3++2H2O,
故答案為:AlO2-+4H+=Al3++2H2O;
(4)L為紅褐色沉淀,則L為Fe(OH)3,化合反應生成氫氧化鐵defy為氫氧化亞鐵和氧氣、水反應生成氫氧化鐵,反應的化學方程式為:4Fe(OH)3+O2+2H2O=4Fe(OH)3,
故答案為:4Fe(OH)3+O2+2H2O=4Fe(OH)3;
(5)常溫下,在pH=12的F為NaOH溶液中逐漸滴入pH=2的CH3COOH至pH=7后,c(H+)=c(OH-),溶液中存在電荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(Na+)=c(CH3COO-)>c(H+)=c(OH-),
所得溶液中離子濃度的大小關系是
故答案為:c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(6)從K為FeCl3的結晶水合物制備K的無水晶體,需要防止鐵離子水解生成氫氧化鐵沉淀,所以加熱失去結晶水的操作為:在干燥的HCl氣流中加熱失水,
故答案為:在干燥的HCl氣流中加熱失水;
(7)在J為FeCl2的溶液中加入酸化H2O2的反應是過氧化氫氧化亞鐵離子生成鐵離子,反應的離子方程式為:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案為:2Fe2++H2O2+2H+=2Fe3++2H2O.
點評 本題考查無機物的推斷,為高頻考點,綜合考查元素化合物知識,把握鋁熱反應及兩性化合物的性質為解答的關鍵,側重Al、Fe及其化合物之間轉化反應的考查,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 溶液顯電中性,膠體帶有電荷 | |
| B. | 用滲析的方法“凈化”膠體時,使用的半透膜只能讓分子通過 | |
| C. | 可用丁達爾效應區分溶液和膠體 | |
| D. | 膠體不穩定,靜置后容易產生沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaClO3 | B. | NaCl | C. | ClO2 | D. | HCl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③④⑤ | B. | ①②③④ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子的還原性強弱:Iˉ>Fe2+>Clˉ | |
| B. | 當a≥b時,發生的離子反應:2Fe2++Cl2=2Fe3++2Clˉ | |
| C. | 當a=b時,反應后的離子濃度之比:c(Fe2+):c(Clˉ)=1:2 | |
| D. | 當3a≤2b時,發生的離子反應:2Fe2++4Iˉ+3Cl2=2Fe3++2I2+6Clˉ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③⑤ | B. | ②④ | C. | ①④ | D. | ④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 | 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | a | 1.80 |
| 328.2 | 9.00 | 7.50 | 6.00 | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | 318.2K,蔗糖起始濃度為0.400 mol•L-1,10min后蔗糖濃度略大于0.376 mol•L-1 | |
| B. | b K時,若蔗糖的濃度為0.35 mol•L-1,則v=1.26 mmol•L-1•min-1 | |
| C. | b<318.2 | |
| D. | 若同時改變反應溫度和蔗糖的濃度,則v肯定變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com