
| 容器編號 | 起始時各物質物質的量/mol | 達平衡時體系能量的變化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出熱量:23.15kJ |
| ② | 0.8 | 2.4 | 0.4 | 放出熱量:Q |
| A. | 容器①、②中反應的平衡常數(shù)相等,平衡時氮氣的轉化率相等 | |
| B. | 平衡時,兩個容器中NH3 的體積分數(shù)均為1/8 | |
| C. | 容器②中達平衡時放出的熱量Q=4.63 kJ | |
| D. | 若容器①改為恒壓體系,充入0.25 L He,則平衡時放出的熱量大于23.15 kJ |
分析 平衡常數(shù)只與溫度有關;利用反應熱計算生成氨氣的物質的量,進而根據(jù)化學方程式計算生成氨氣的體積分數(shù);從平衡移動的角度比較反應放出的熱量與23.15kJ的關系.
解答 解:A、平衡常數(shù)只與溫度有關,相同溫度下,體積均為0.25L的兩個恒容密閉容器中發(fā)生相同的反應,則平衡常數(shù)應相同,①②是等效平衡,但①起始氮氣的物質的量大,所以轉化率小,故A錯誤;
B、①容器中放出23.15kJ熱量,則生成氨氣的物質的量為:$\frac{2mol×23.15KJ}{92.6KJ}$=0.5mol,利用三段式法計算:
N2(g)+3H2(g)?2NH3(g)△H=一92.6kJ/mol
起始:1mol 3mol 0
轉化:0.25mol 0.75mol 0.5mol
平衡:0.75mol 2.25mol 0.5mol
平衡時,①容器中NH3的體積分數(shù)等于氣體的物質的量分數(shù)$\frac{0.5mol}{0.75mol+2.25mol+0.5mol}$=$\frac{1}{7}$,從等效平衡的角度分析,0.9molN2、2.7molH2和0.2molNH3相當于1molN2、3molH2,在相同條件下處于相同平衡狀態(tài),所以平衡時兩個容器內氨氣的體積分數(shù)相等,故B錯誤;
C、②平衡時生成0.1mol的氨氣,而生成2mol的氨氣放出熱量為:$\frac{92.6×0.1}{2}$=4.63 kJ,故C正確;
D、若若容器①改為恒壓體系,充入0.25 L He,相當于在原來的基礎上減小壓強,平衡逆向移動,平衡時放出的熱量小于23.15kJ,故D錯誤;
故選C.
點評 本題考查化學平衡移動問題,題目難度不大,注意B項從等效平衡的角度分析,為該題的易錯點.


 學業(yè)測評一課一測系列答案
學業(yè)測評一課一測系列答案科目:高中化學 來源: 題型:解答題
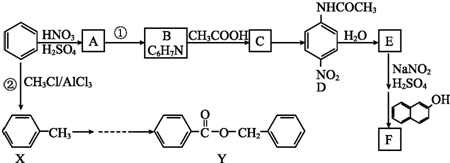
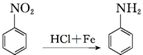
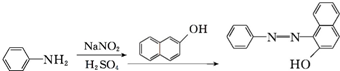
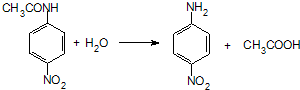 .
. 、F
、F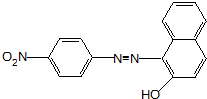 .
.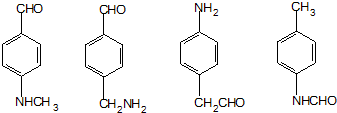 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
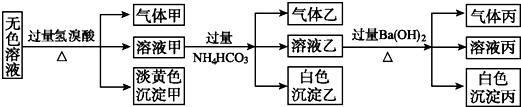
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 自然界中的金屬都是以化合態(tài)形式存在的 | |
| B. | 工業(yè)上可利用反應:Mg+2KCl═MgCl2+2K↑進行金屬鉀的冶煉 | |
| C. | 利用潮汐發(fā)電是將化學能轉化為電能 | |
| D. | 將海水蒸干可以直接獲得食用鹽 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 物質的量濃度相等的CH3COOH和CH3COONa溶液等體積混合:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) | |
| B. | 0.1mol/L pH為4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| D. | pH=3的醋酸溶液與pH=11的氫氧化鈉溶液等體積混合后pH=7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
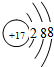 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
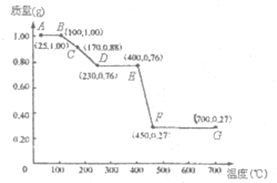 如圖是1.00g MgC2O4•nH2O晶體放在坩堝里從25℃徐徐加熱至700℃時,所得同體產物的質量(m)隨溫度(t)變化的關系曲線.(已知100℃以上才會逐漸失去結晶水,并約在230℃時完全失去結晶水)
如圖是1.00g MgC2O4•nH2O晶體放在坩堝里從25℃徐徐加熱至700℃時,所得同體產物的質量(m)隨溫度(t)變化的關系曲線.(已知100℃以上才會逐漸失去結晶水,并約在230℃時完全失去結晶水)查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com