
| A. | 物質的量濃度相等的CH3COOH和CH3COONa溶液等體積混合:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) | |
| B. | 0.1mol/L pH為4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| D. | pH=3的醋酸溶液與pH=11的氫氧化鈉溶液等體積混合后pH=7 |
分析 A.等濃度等體積CH3COOH和CH3COONa混合溶液中電荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)物料守恒c(CH3COOH)+c(CH3COO-=2c(Na+)由兩個守恒計算分析;
B.NaHB 0.1mol/L而PH=4說明該鹽屬弱酸酸式鹽顯酸性說明電離程度大于水解程度;
C.氯水中存在化學平衡Cl2+H2O?HCl+HClO,次氯酸是弱酸;
D.pH=3的醋酸溶液和pH=11NaOH溶液等體積混合,平衡狀態下的氫離子和氫氧根離子反應后,醋酸又電離出氫離子.
解答 解:A.等濃度等體積CH3COOH和CH3COONa混合溶液中電荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)物料守恒c(CH3COOH)+c(CH3COO-=2c(Na+)由兩個守恒可推導出2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-),故A正確;
B.NaHB 0.1mol/L而PH=4說明該鹽屬弱酸酸式鹽顯酸性說明電離程度大于水解程度,應為c(HB-)>c(B2-)>c(H2B),故B錯誤;
C.氯水中存在化學平衡Cl2+H2O?HCl+HClO,溶液中離子濃度大小c(H+)>c(Cl-)>c(ClO-)>c(OH-),故C錯誤;
D.pH=3的醋酸溶液和pH=11NaOH溶液等體積混合,平衡狀態下的氫離子和氫氧根離子反應后,醋酸又電離出氫離子,反應后溶液顯酸性,故D錯誤;
故選A.
點評 本題考查了電解質溶液中離子濃度大小比較、弱電解質電離平衡、溶液中電荷守恒和電荷守恒的計算應用,掌握基礎是解題關鍵,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①②反應均是氧化還原反應 | |
| B. | KI在整個反應過程中起催化作用 | |
| C. | KI在整個反應過程中起氧化作用 | |
| D. | “溶液突然變為藍色,隨之又很快消失”這一現象與①②的反應速率有關 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
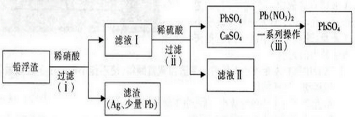
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
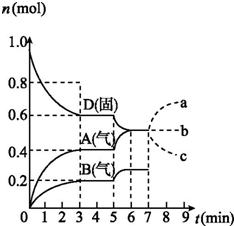 在容積為2.0 L的密閉容器內,物質D在T℃時發生反應,其反應物和生成物的物質的量隨時間t的變化關系如圖,下列敘述錯誤的是( )
在容積為2.0 L的密閉容器內,物質D在T℃時發生反應,其反應物和生成物的物質的量隨時間t的變化關系如圖,下列敘述錯誤的是( )| A. | 從反應開始到第一次達到平衡時,B物質的平均反應速率為0.033 3 mol/(L•min) | |
| B. | 根據右圖該反應的平衡常數表達式為K=c2(A)•c(B) | |
| C. | 若在第5 min時升高溫度,則該反應的正反應是吸熱反應,反應的平衡常數增大,B的反應速率增大 | |
| D. | 若在第7 分鐘時增加D的物質的量,A的物質的量變化情況符合a曲線 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 容器編號 | 起始時各物質物質的量/mol | 達平衡時體系能量的變化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出熱量:23.15kJ |
| ② | 0.8 | 2.4 | 0.4 | 放出熱量:Q |
| A. | 容器①、②中反應的平衡常數相等,平衡時氮氣的轉化率相等 | |
| B. | 平衡時,兩個容器中NH3 的體積分數均為1/8 | |
| C. | 容器②中達平衡時放出的熱量Q=4.63 kJ | |
| D. | 若容器①改為恒壓體系,充入0.25 L He,則平衡時放出的熱量大于23.15 kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
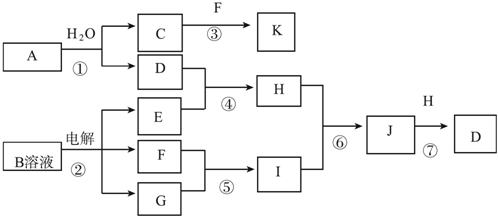
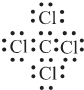 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
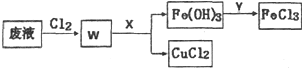 銅及其化合物在工農業生產中有著廣泛的用途.
銅及其化合物在工農業生產中有著廣泛的用途.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 被稱為“史上最嚴”的新《環境保護法》正式實施,我們要運用化學原理從源頭上減少和消除工業生產對環境的污染 | |
| B. | 天津港爆炸事故救援過程中,消防員若發現存放金屬鈉、電石、甲苯二異氰酸酯等化學品的倉庫起火,應立即用泡沫滅火器將火撲滅 | |
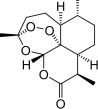
| C. | 世界衛生組織認為青蒿素(結構如圖所示)聯合療法是當下治療瘧疾最有效的手段,烴類物質青蒿素已經拯救了上百萬生命 | |
| D. | 某品牌化妝品在廣告中反復強調產品中不含任何化學成分,是“十年專注自然護膚”的優質產品 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com