
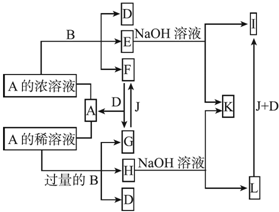
分析 A、B、C、D、E、F是六種短周期主族元素,它們的原子序數依次增大,F元素的最外層電子數是次外層電子數的0.75倍,則次外層電子為8,最外層電子數為6,則F為S元素,C、F是同一主族元素,則C為O元素;B元素的最外層電子數是內層電子數的2倍,原子只能有2個電子層,內層電子數為2,則最外層電子數為4,所以B為C元素;E元素的最外層電子數等于其電子層數,則為第三周期第ⅢA族,即E為Al元素;A、F兩元素的原子核中質子數之和比C、D兩元素原子核中質子數之和少2,則A、D的質子數相差10,故A為H元素,D為Na元素,據此解答.
解答 解:A、B、C、D、E、F是六種短周期主族元素,它們的原子序數依次增大,F元素的最外層電子數是次外層電子數的0.75倍,則次外層電子為8,最外層電子數為6,則F為S元素,C、F是同一主族元素,則C為O元素;B元素的最外層電子數是內層電子數的2倍,原子只能有2個電子層,內層電子數為2,則最外層電子數為4,所以B為C元素;E元素的最外層電子數等于其電子層數,則為第三周期第ⅢA族,即E為Al元素;A、F兩元素的原子核中質子數之和比C、D兩元素原子核中質子數之和少2,則A、D的質子數相差10,故A為H元素,D為Na元素.
(1)E、F二種元素組成的化合物為Al2S3,由A、C、D三種元素組成的化合物為NaOH,Al2S3先發生雙水解反應生成2 molAl(OH)3和3 molH2S,再與氫氧化鈉溶液反應生成NaAlO2、Na2SO3,由原子守恒可知1molAl2S3消耗NaOH為1mol×2+3mol×2=8mol,
故答案為:8mol;
(2)A、C、F間可形成甲、乙兩種微粒,它們均為負一價雙原子陰離子,甲有18個電子,乙有10個電子,則甲為HS-、乙為OH-,甲與乙反應的離子方程式為:HS-+OH-=S2-+H2O,
故答案為:HS-+OH-=S2-+H2O;
(3)由題意可得熱化學方程式:①C(s)+O2(g)═CO2(g)△H=-a kJ•mol-1
②CO2(g)═CO(g)+$\frac{1}{2}$O2(g)△H=+2b kJ•mol-1
由蓋斯定律知,①+②可得:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-(a-2b) kJ•mol-1,
故答案為:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-(a-2b) kJ•mol-1;
(4)反應方程式為:CO(g)+H2O(g)═CO2(g)+H2(g),該反應前后的氣體系數相等,因此,在容器體積相同時,按成倍的不同的起始量加入反應物,平衡不受影響,反應程度相同,為等效平衡,但速率不同,濃度大時速率快,則:
A.反應速率Ⅰ<Ⅱ,故達到平衡所需要的時間:Ⅰ>Ⅱ,故A正確;
B.反應程度相同,Ⅰ、Ⅱ中轉化率相等,故B正確;
C.轉化率相等,則達到平衡后BC的物質的量:Ⅰ<Ⅱ,故C錯誤;
D.二者為等效平衡,平衡后A2的體積分數相等,故D錯誤;
E.Ⅱ中參加反應的反應物的量更大,故達到平衡后吸收或放出的熱量:Ⅰ<Ⅱ,故E錯誤;
F.達到平衡后體系中同種組分的含量相等,則平均相對分子質量相等,故F錯誤,
故選:AB;
(5)用碳元素的單質與Al制成電極浸入由NaOH的溶液中構成電池,總反應為2Al+2NaOH+2H2O═2NaA1O2+3H2↑,可知負極的電極反應式Al-3e-+4OH-═AlO2-+2H2O,
故答案為:Al-3e-+4OH-═AlO2-+2H2O.
點評 本題考查位置結構性質的關系、原電池原理、熱化學方程式書寫、化學平衡移動、化學計算等,綜合性較強,元素的推斷是解答本題的關鍵,(1)中注意硫化鋁在水中發生的雙水解反應,難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 殺死水果周圍的細菌,防止水果霉變 | |
| B. | 吸收水果周圍的氧氣,防止水果腐爛 | |
| C. | 吸收水果產生的乙烯,防止水果早熟 | |
| D. | 氧化性較強,催熟水果 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | ①②④⑤ | B. | ①②③ | C. | ③④⑤ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 容器編號 | 起始時各物質物質的量/mol | 達平衡時體系能量的變化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出熱量:23.15kJ |
| ② | 0.8 | 2.4 | 0.4 | 放出熱量:Q |
| A. | 容器①、②中反應的平衡常數相等,平衡時氮氣的轉化率相等 | |
| B. | 平衡時,兩個容器中NH3 的體積分數均為1/8 | |
| C. | 容器②中達平衡時放出的熱量Q=4.63 kJ | |
| D. | 若容器①改為恒壓體系,充入0.25 L He,則平衡時放出的熱量大于23.15 kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入Al能放出H2的溶液中:ClO-、HCO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、NH${\;}_{4}^{+}$ | |
| B. | pH=2的溶液中:Fe2+、Na+、Mg2+、NO${\;}_{3}^{-}$ | |
| C. | 能使KSCN溶液變紅的溶液中:Na+、I-、NO${\;}_{3}^{-}$、HCO${\;}_{3}^{-}$ | |
| D. | 由水電離出的c(OH-)=1.0×10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、Br- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
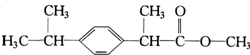 某種藥物主要成分X的分子結構如圖,關于有機物X的說法中錯誤的是( )
某種藥物主要成分X的分子結構如圖,關于有機物X的說法中錯誤的是( )| A. | ①④ | B. | ②④ | C. | ②③ | D. | ①② |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某溶液中,可能含有下表所列離子中的某幾種:
某溶液中,可能含有下表所列離子中的某幾種:| 陽離子 | Al3+、Mg2+、NH4+、Na+ |
| 陰離子 | CO32-、SiO32-、[Al(OH)4]-、Cl- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com