
| A. | 常溫常壓下,氯氣呈氣態而溴單質呈液態 | |
| B. | 硝酸是揮發性酸,硫酸是難揮發性的酸 | |
| C. | 稀有氣體一般難發生化學反應 | |
| D. | 氮氣在常溫下很穩定,化學性質不活潑 |
分析 A.根據組成和結構相似的分子晶體,相對分子質量越大,熔、沸點越高;
B.硝酸、硫酸和磷酸固態時都屬分子晶體,熔、沸點的高低由分子間作用力的大小決定;
C.稀有氣體為單原子分子,原子都是穩定結構;
D.物質的穩定性與鍵能有關.
解答 解:A.氯氣的相對分子質量比溴單質小,所以氯氣的沸點比溴單質低,在常溫常壓下氯氣呈氣態而溴單質呈液態,與鍵能無關,故A錯誤;
B.硝酸的分子間作用力小,沸點低,是揮發性,酸硫酸、磷酸的分子間作用力大,沸點高,是不揮發性酸,與鍵能無關,故B錯誤;
C.稀有氣體為單原子分子,原子都形成穩定結構,稀有氣體一般難于發生化學反應,與鍵能無關,故C錯誤;
D.氮氣分子中N≡N的鍵能很大,分子很穩定,故氮氣在常溫下很穩定,化學性質不活潑,與鍵能有關,故D正確;
故選D.
點評 本題考查化學鍵和分子間作用力這兩個不同概念,需要注意的是物質的穩定性與鍵能有關,題目難度不大.


 優化作業上海科技文獻出版社系列答案
優化作業上海科技文獻出版社系列答案科目:高中化學 來源: 題型:選擇題
| 編號 | (1) | (2) | (3) | (4) |
| 反應速率[mol/(L.s)] | v(SO2) | v(O2) | v(SO3) | v(O2) |
| 0.4 | 0.25 | 0.5 | 0.3 |
| A. | (1) | B. | (2) | C. | (3) | D. | (4) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 掌握儀器的名稱、組裝及使用方法是中學化學實驗的基礎,下圖為兩套實
掌握儀器的名稱、組裝及使用方法是中學化學實驗的基礎,下圖為兩套實
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗操作 | 實驗現象 | 結論 |
| 打開活塞a,向圓底燒瓶中滴入適量濃鹽酸;然后關閉活塞a,點燃酒精燈. | D裝置中:溶液變紅 E裝置中:水層溶液變黃,振蕩后,CCl4層無明顯變化. | Cl2、Br2、Fe3+的氧化性由強到弱的順序為:Cl2>Br2>Fe3+ |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 )分子中有5n個σ鍵
)分子中有5n個σ鍵| 化學鍵 | Si-Si | O═O | Si-O |
| 鍵能(kJ•mol-1) | a | b | c |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,1.12LSO3所含的原子數是0.2NA | |
| B. | 3.9gNa2O2吸收足量的CO2時轉移電子數是0.05NA | |
| C. | 20g重水中含有中子數為8NA | |
| D. | 28g乙烯和環丁烷(C4H8)的混合氣體中含有的碳原子數為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
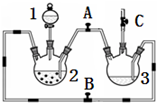 某化學興趣小組擬用右圖裝置制備氫氧化亞鐵并觀察其顏色.提供化學藥品:鐵粉、稀硫酸、氫氧化鈉溶液.
某化學興趣小組擬用右圖裝置制備氫氧化亞鐵并觀察其顏色.提供化學藥品:鐵粉、稀硫酸、氫氧化鈉溶液.| 實驗次數 | 第一次 | 第二次 | 第三次 |
| 消耗高錳酸鉀溶液體積/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④ | B. | ②③⑥⑦⑧ | C. | ⑤⑥⑦⑧ | D. | ④⑦⑧ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com