
| 容器編號 | 起始物質的量mol | 4分鐘后平衡時的物質量mol | 平衡時放出的熱量/KJ | |
| I2 | H2 | HI | ||
| 甲 | 0.01 | 0.01 | 0.004 | Q1 |
| 乙 | 0.02 | 0.02 | a | Q2 |
| A. | 甲容器中,4分鐘內氫氣的反應速率為5.0×10-4rmol/(L•min) | |
| B. | 平衡時,放出的熱量:Q1=4.0×10-3Q kJ | |
| C. | 平衡后,a=8.0×10-3mol,故乙中HI的質量分數比甲中高 | |
| D. | 該溫度下,該反應的平衡常數K=0.25 |
分析 甲中平衡時HI的濃度為0.004mol,則:
H2(g)+I2(g)?2HI(g)△H=-14.9kJ/mol
開始(mol):0.01 0.01 0
變化(mol):0.002 0.002 0.004
平衡(mol):0.008 0.008 0.004
乙中I2、H2為甲的2倍,因反應前后氣體的計量數之和相等,則增大壓強平衡不一定,甲、乙平衡狀態相同,以此解答該題.
解答 解:甲中平衡時HI的濃度為0.004mol,則:
H2(g)+I2(g)?2HI(g)△H=-14.9kJ/mol
開始(mol):0.01 0.01 0
變化(mol):0.002 0.002 0.004
平衡(mol):0.008 0.008 0.004
A.甲容器中,4分鐘內氫氣的反應速率為$\frac{\frac{0.002mol}{2L}}{4min}$=2.5.0×10-4 mol•L-1•min-1,故A錯誤;
B.平衡時,放出的熱量為:Q1=0.002mol×QkJ•mol-1=2.0×10-3Q kJ,故B錯誤;
C.甲、乙平衡狀態相同,則各物質的含量也相同,故C錯誤;
D.該溫度下,該反應的平衡常數K=$\frac{(\frac{0.004}{2})^{2}}{\frac{0.008}{2}×\frac{0.008}{2}}$=0.25,故D正確.
故選D.
點評 本題考查等效平衡、化學平衡常數的計算等知識,為高頻考點,側重于學生的分析能力的考查,主要把握甲乙平衡狀態的判斷,難度中等,注意理解等效平衡規律.


科目:高中化學 來源: 題型:解答題
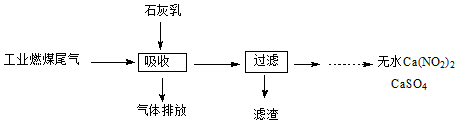
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖中的兩條線分別代表的是:1g C3H6和1g M氣體在相同容積的容器中,測得容器中的壓強和溫度的關系,試根據圖形判斷M氣體的相對分子質量為( )
如圖中的兩條線分別代表的是:1g C3H6和1g M氣體在相同容積的容器中,測得容器中的壓強和溫度的關系,試根據圖形判斷M氣體的相對分子質量為( )| A. | 63 | B. | 28 | C. | 42 | D. | 無法計算 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
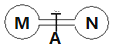 室溫時,兩個容積相同的燒瓶中分別盛有M和N兩種氣體(同溫同壓),取下彈簧夾A,使兩燒瓶內的氣體充分接觸(如圖),容器內的壓強由大到小的順序是( )
室溫時,兩個容積相同的燒瓶中分別盛有M和N兩種氣體(同溫同壓),取下彈簧夾A,使兩燒瓶內的氣體充分接觸(如圖),容器內的壓強由大到小的順序是( )| 編號 | ① | ② | ③ | ④ |
| 氣體M | H2S | NH3 | HI | NO |
| 氣體N | SO2 | HCl | Cl2 | O2 |
| A. | ③=④>①>② | B. | ③>④>①>② | C. | ④>③>②>① | D. | ④>③>①>② |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 根據反應MnO4-+5Fe2++8H+=Mn2-+5Fe3++4H2O可知,用酸性KMnO4溶液可檢驗FeSO4•7H2O是否變質 | |
| B. | 用CO2鑒別NaAlO2溶液和CH3COONa溶液 | |
| C. | 用濕潤的碘化鉀淀粉試劑鑒別Br2(g)和NO2 | |
| D. | 用KOH溶液鑒別SO3(g)和SO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4+ K+ Ca2+ NO3- | B. | K+ Al3+ Br- NO3- | ||
| C. | Ba2+ K+ SO42- NO3- | D. | H+ K+ SO42- Cl- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com