
| 溫度/K | 反應I | 反應II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |

分析 (1)已知K1>K1′,說明隨溫度升高,K減小,則反應Ⅰ為放熱反應,△H1<0;K2>K2′,說明隨溫度升高,K減小,則反應II為放熱反應,△H2<0;反應I-反應II×3得到反應III,則△H3=△H1-3△H2,據此分析;
(2)①已知4分鐘時氮氣為2.5mol,則消耗的NO為3mol,根據v(NO)=$\frac{△c}{△t}$計算;
②A.相同時間內生成的氮氣的物質的量越多,則反應速率越快,活化能越低;
B.改變壓強,活化分子百分數不變;
C.單位時間內H-O鍵斷裂表示逆速率,N-H鍵斷裂表示正速率,正逆速率相同則反應已經達到平衡;
D.該反應為放熱反應,恒容絕熱的密閉容器中,反應時溫度會升高,則K會減小;
(3)恒溫恒壓容器,再充入NO2氣體,則與原來的平衡為等效平衡;若恒溫恒容容器中,再充入NO2氣體,容器中壓強增大,則平衡正向移動;
(4)①圖象分析曲線X變化為曲線Y是縮短反應達到平衡的時間,最后達到相同平衡狀態,體積是可變的恒壓容器,說明改變的是加入了催化劑;當曲線X變為曲線Z時N2物質的量濃度增大,可變容器中氣體體積和濃度成反比;
②反應III為吸熱反應,若t2降低溫度,則平衡逆向移動,氮氣的濃度減小.
解答 解:(1)已知K1>K1′,說明隨溫度升高,K減小,則反應Ⅰ為放熱反應,△H1<0;K2>K2′,說明隨溫度升高,K減小,則反應II為放熱反應,△H2<0;反應I-反應II×3得到反應III,則△H3=△H1-3△H2,已知|△H1|=2|△H2|,所以△H3=△H1-3△H2=|△H2|>0,即反應III為吸熱反應,
故答案為:吸熱;
(2)①已知4分鐘時氮氣為2.5mol,則消耗的NO為3mol,所以v(NO)=$\frac{△c}{△t}$=$\frac{\frac{3mol}{2L}}{4min}$=0.375mol•L-1•min-1,
故答案為:0.375mol•L-1•min-1;
②A.相同時間內生成的氮氣的物質的量越多,則反應速率越快,活化能越低,所以該反應的活化能大小順序是:Ea(A)<Ea(B)<Ea(C),故A錯誤;
B.增大壓強能使反應速率加快,是因為增大了活化分子數,而活化分子百分數不變,故B錯誤;
C.單位時間內H-O鍵斷裂表示逆速率,N-H鍵斷裂表示正速率,單位時間內H-O鍵與N-H鍵斷裂的數目相等時,則消耗的NH3和消耗的水的物質的量之比為4:6,則正逆速率之比等于4:6,說明反應已經達到平衡,故C正確;
D.該反應為放熱反應,恒容絕熱的密閉容器中,反應時溫度會升高,則K會減小,當K值不變時,說明反應已經達到平衡,故D正確;
故答案為:CD;
(3)一定條件下,反應II2NO(g)+O2(g)?2NO2(g)達到平衡時體系中n(NO):n(O2):n(NO2)=2:1:2.在其它條件不變時,恒溫恒壓條件下,再充入NO2氣體,則與原來的平衡為等效平衡,則NO2體積分數與原來平衡相同;若恒溫恒容容器中,再充入NO2氣體,容器中壓強增大,與原來平衡相比較,平衡正向移動,則NO2體積分數變大;
故答案為:不變;變大;
(4)①分析圖象可知曲線X變化為曲線Y是縮短反應達到平衡的時間,最后達到相同平衡狀態,反應中體積是可變的,已知是恒壓容器,說明改變的是加入了催化劑,當曲線X變為曲線Z時N2物質的量濃度增大,可變容器中氣體體積和濃度成反比,曲線X,體積為3L,N2濃度為3mol/L,改變條件當曲線X變為曲線Z時,N2濃度為4.5mol/L,則體積壓縮體積為:3:V=4.5:3,V=2L,所以將容器的體積快速壓縮至2L符合;
故答案為:加入催化劑;將容器的體積快速壓縮至2L;
②反應III為吸熱反應,若t2降低溫度,則平衡逆向移動,氮氣的濃度減小,在t3達到平衡,曲線X在t2-t4內 c(N2)的變化曲線為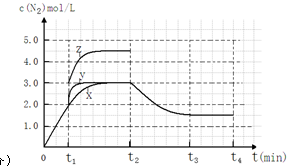 ,
,
故答案為: .
.
點評 本題考查了化學平衡影響因素分析判斷、平衡常數的應用、反應速率計算、平衡狀態的判斷等,題目難度較大,側重于考查學生對基礎知識的綜合應用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 44g CO2含有的原子數目為NA | |
| B. | 常溫常壓下,22.4L CCl4含有的分子數目為NA | |
| C. | 32gCu與足量濃硝酸充分反應,轉移電子數目為NA | |
| D. | 1mol•L-1CuSO4溶液中含有的硫酸根離子數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 比4He少一個質子 | B. | 比4He多一個中子 | ||
| C. | 是4He的同素異形體 | D. | 是4He的同位素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
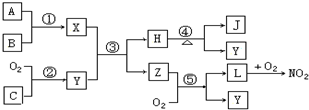
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
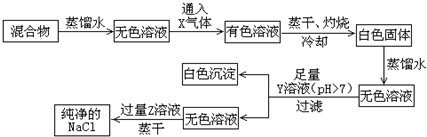
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗步驟 | 實驗現象 |
| (1)取少量該溶液,加幾滴甲基橙 | 溶液變紅色 |
| (2)取少量該溶液加熱濃縮,加Cu片和濃硫酸,加熱 | 有無色氣體產生,氣體遇空氣可以變成紅棕色 |
| (3)取少量該溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中的上層清液,加AgNO3溶液 | 有穩定的白色沉淀生成,且不溶于稀硝酸 |
| (5)取少量該溶液,加入NaOH溶液 | 有白色沉淀生成,當NaOH過量時,沉淀部分溶解 |
| A. | 根據實驗(1)可以確定溶液中不含有HCO3-和I-,因為這二個離子相對應的酸為弱酸 | |
| B. | 溶液中一定存在的離子是NO3-、SO42-、Cl-、Mg2+、Al3+;溶液中肯定不存在的離子是:Fe2+、HCO3-、I-、Ba2+ | |
| C. | 為進一步確定其它離子,應該補充焰色反應的實驗來檢驗K+就可以 | |
| D. | 通過實驗(1)和(2)就可以確定溶液中一定含有NO3-,一定不含有Fe2+、I-、HCO3-,所以實驗步驟(4)的設計是錯誤的 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
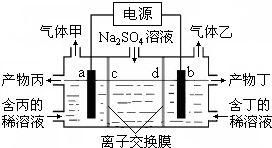 工業上常用電解硫酸鈉溶液聯合生產硫酸和燒堿,生產裝置如圖所示,其中陰極和陽極均為惰性電極.測得同溫同壓下,氣體甲與氣體乙的體積比約為1:2,以下說法中正確的是( )
工業上常用電解硫酸鈉溶液聯合生產硫酸和燒堿,生產裝置如圖所示,其中陰極和陽極均為惰性電極.測得同溫同壓下,氣體甲與氣體乙的體積比約為1:2,以下說法中正確的是( )| A. | a極與電源的負極相連 | B. | 產物丙為硫酸溶液 | ||
| C. | 離子交換膜d為陰離子交換膜 | D. | b電極反應式:4OH--4e-=O2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
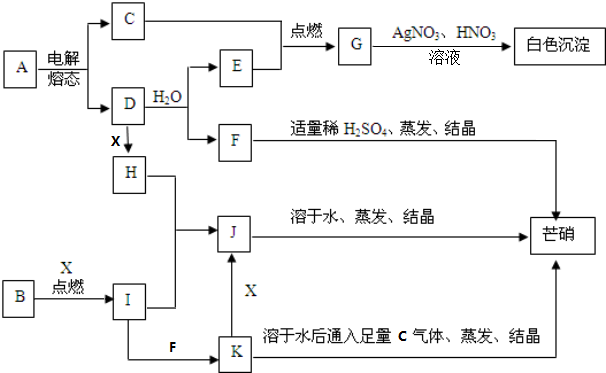
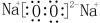 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 人的皮膚在強紫外線的照射下不會失去生理活性 | |
| B. | 常用新制的氫氧化銅檢驗司機酒后駕車 | |
| C. | 棉花和木材的主要成分都是纖維素 | |
| D. | 蜂蟻叮咬人的皮膚時將分泌物甲酸注入人體,此時可在患處涂抹食醋緩解不適 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com