
| A. | 標準狀況下,22.4 L的H2O中含有的分子數為NA | |
| B. | 7.8g Na2S固體和7.8 g Na2O2固體中含有的陰離子數目均為0.1NA | |
| C. | 46克 Na與足量氧氣反應轉移的電子數為2NA | |
| D. | 1 L 1mol•L-1 Na2CO3溶液中含有的鈉離子數為NA |
分析 A、標況下水為液態;
B、Na2S和Na2O2的摩爾質量均為78g/mol,且兩者均由2mol鈉離子和1mol陰離子構成來分析;
C、求出鈉的物質的量,然后根據反應后變為+1價來分析;
D、求出碳酸鈉的物質的量,然后根據1mol碳酸鈉含2mol鈉離子來分析.
解答 解:A、標況下水為液態,故不能根據氣體摩爾體積來計算其物質的量,故A錯誤;
B、Na2S和Na2O2的摩爾質量均為78g/mol,故7.8g過氧化鈉和硫化鈉的物質的量均為0.1mol,且兩者均由2mol鈉離子和1mol陰離子構成來分析,故0.1mol過氧化鈉和0.1mol硫化鈉中均含0.1mol陰離子即0.1NA個,故B正確;
C、46g鈉的物質的量為2mol,而反應后變為+1價,故2mol鈉失去2mol電子即2NA個,故C正確;
D、溶液中碳酸鈉的物質的量n=CV=1mol/L×1L=1mol,而1mol碳酸鈉含2mol鈉離子,故1mol碳酸鈉中含2mol鈉離子即2NA個,故D錯誤.
故選BC.
點評 本題考查了阿伏伽德羅常數的有關計算,熟練掌握公式的使用和物質的結構是解題關鍵,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 在過氧化鈉與水的反應中.固體每增重mg,轉移電子為0.2NA | |
| B. | 在準狀況下,2.24LCl2與過量NaOH溶液反應,轉移的電子總數為0.2NA | |
| C. | 已知反應:2NH3+NO+NO2═2N2+3H2O,每生成2molN2轉移的電子數為6NA | |
| D. | 標準狀況下,22.4LCCl4中含有的碳原子數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 如試管外壁有水,應在加熱前擦拭干凈 | |
| B. | 先使試管均勻受熱,即先進行預熱,然后把燈焰固定在放固體的部位加熱 | |
| C. | 試管夾夾在距試管口約$\frac{1}{3}$處 | |
| D. | 加熱完畢,立即用冷水沖洗試管 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
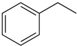 (g)→
(g)→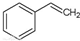 (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol; +CO(g)+H2O(g) △H=+158.8 kJ/mol
+CO(g)+H2O(g) △H=+158.8 kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 開始時,產生氫氣的速率相同 | |
| B. | 參加反應的金屬的物質的量比為1:1:1 | |
| C. | 所得溶液的質量相等 | |
| D. | 參加反應的金屬的質量比為12:9:28 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ①②④⑤ | C. | ①②④⑤⑥ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 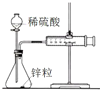 圖中測定鋅粒與1 mol/L稀硫酸反應速率,只需測定量筒中收集氫氣的體積 | |
| B. |  裝置中進行50 mL 0.50 mol/L鹽酸與50 mL 0.55 mol/L NaOH溶液測定中和熱,使溫度計溫度升高的熱量就是中和反應生成1 mol水的熱量 | |
| C. | 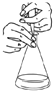 酸堿中和滴定中,可以在滴定過程中用少量水沖洗錐形瓶內壁以減小實驗誤差 | |
| D. |  滴定管中讀數為26.50mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,2.24L丙烷中含有的共用電子對數為NA | |
| B. | 25℃時,pH=1的鹽酸和醋酸溶液所含H+數均為0.1 NA | |
| C. | 利用雙氧水制氧氣,每生成1molO2轉移電子數為4 NA | |
| D. | 100mL 12mo1•L-1的濃鹽酸與足量MnO2加熱反應,生成C12分子數為0.3 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 弱堿性溶液中:Na+、K+、Cl-、HCO3- | |
| B. | 無色透明的酸性溶液中:Al3+、NH4+、Cl?、HCO3? | |
| C. | pH=1的溶液中:ClO-、SO42-、Fe2+、K+ | |
| D. | 由水電離的c(OH-)=10-14mol•L-1的溶液中:CH3 COO-、SO42-、Na+、NH4+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com