
 (g)→
(g)→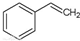 (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol; +CO(g)+H2O(g) △H=+158.8 kJ/mol
+CO(g)+H2O(g) △H=+158.8 kJ/mol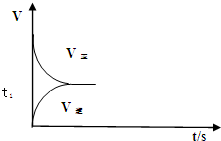
分析 I.(1)根據蓋斯定律,結合已知方程式計算反應熱,然后寫熱化學方程式;方程式相加時,總平衡常數等于分方程的平衡常數之積;
(2)恒溫恒容條件下,反應①達到平衡后;t1時刻通入少量CO2,則正反應速率瞬間增大,逆反應速率逐漸增大;
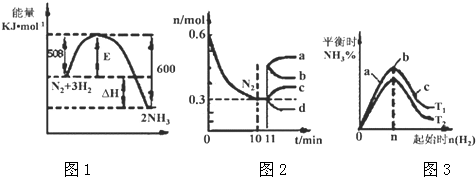
Ⅱ.(3)①由圖象1分析,反應是放熱反應,依據化學方程式和能量變化分析計算放出熱量,依據影響平衡常數因素和平衡移動原理分析;
(4)分析圖象變化量,計算氮氣的反應速率,結合反應速率之比等于系數之比計算得到氫氣速率,依據化學反應速率概念計算得到,縮體積,增大壓強,平衡向正反應移動,改變瞬間n(N2)不變,達平衡是n(N2)減小;
(5)圖3表示平衡時氨氣含量與氫氣起始物質的量關系,曲線上各點都處于平衡狀態,達平衡后,增大氫氣用量,氮氣的轉化率增大;
由圖3可知,氫氣的起始物質的量相同時,溫度T1平衡后,氨氣的含量更高,該反應為放熱反應,降低溫度平衡向正反應移動,故溫度T1<T2,據此解答;
解答 解:(1)已知反應①:CO2(g)+H2(g)→CO(g)+H2O(g)△H=+41.2kJ/mol;
反應②: (g)→
(g)→ (g)+H2(g)△H=+117.6kJ/mol;
(g)+H2(g)△H=+117.6kJ/mol;
根據蓋斯定律:①+②,得 CO2(g)+ +CO(g)+H2O(g) △H=+41.2+117.6=+158.8kJ/mol,
+CO(g)+H2O(g) △H=+41.2+117.6=+158.8kJ/mol,
反應①與②相加得總方程,則總方程的平衡常數等于分方程的平衡常數之積,即K=K1•K2,
故答案為:CO2(g)+ +CO(g)+H2O(g) △H=+158.8 kJ/mol;K1•K2;
+CO(g)+H2O(g) △H=+158.8 kJ/mol;K1•K2;
(2)恒溫恒容條件下,反應①達到平衡后;t1時刻通入少量CO2,則正反應速率瞬間增大,逆反應速率逐漸增大,其t1之后的正逆反應曲線為: ,故答案為:
,故答案為: ;
;
Ⅱ.(3)N2(g)+3H2(g)?2NH3(g),反應的焓變△H=-(600KJ/mol-508KJ/mol)=-92KJ/mol;圖2分析可知反應進行的氮氣的起始量為0.6mol,反應過程中消耗氮氣物質的量為0.3mol,依據熱化學方程式計算得到反應過程中放熱=92KJ/mol×0.3mol=27.6KJ;
圖象1分析可知反應是放熱反應,反應物能量高于生成物能量,溫度升高平衡逆向進行,平衡常數減小,故答案為:減小;
(4)圖象分析2L的密閉容器中,V(N2)=$\frac{1}{3}$V(H2)=$\frac{\frac{0.6mol-0.3mol}{2L}}{10min}$=0.015mol/L•min,V(H2)=0.045mol/L•min;
從11min起其它條件不變,壓縮容器的體積為1L,壓強增大,平衡正向進行,瞬間氮氣物質的量不變,隨平衡正向進行,氮氣物質的量減小,則n(N2)的變化曲線d符合;
故答案為:0.045mol/L•min;d;
(5)圖3表示平衡時氨氣含量與氫氣起始物質的量關系,曲線上各點都處于平衡狀態,故a、b、c都處于平衡狀態,達平衡后,增大氫氣用量,氮氣的轉化率增大,故a、b、c三點中,c的氮氣的轉化率最高;
由圖3可知,氫氣的起始物質的量相同時,溫度T1平衡后,氨氣的含量更高,該反應為放熱反應,降低溫度平衡向正反應移動,故溫度T1<T2,溫度越高化學平衡越低,故K1>K2;
故答案為:c;<.
點評 本題考查熱化學方程式書寫,化學平衡影響因素分析判斷,圖象分析方法應用等知識,綜合性較大,難度中等,是對知識的綜合運用,需要學生具有扎實的基礎知識.


科目:高中化學 來源: 題型:選擇題
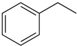
| A. | 用核磁共振氫譜不能鑒別1-丙醇和2-丙醇 | |
| B. | 實驗證實 可使Br2的CCl4溶液褪色,說明該分子中存在獨立的碳碳單鍵和碳碳雙鍵 可使Br2的CCl4溶液褪色,說明該分子中存在獨立的碳碳單鍵和碳碳雙鍵 | |
| C. | 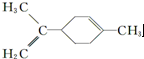 所有碳原子一定在同一平面上 所有碳原子一定在同一平面上 | |
| D. | 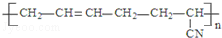 的單體是CH3-C≡C-CH3和CH2═CH-CN 的單體是CH3-C≡C-CH3和CH2═CH-CN |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬鈉與TiCl4溶液反應,可以置換出金屬鈦 | |
| B. | 氫氧化鋁具有弱堿性,可用于做胃酸中和劑 | |
| C. | 漂白粉在空氣中不穩定,可用于漂白紙張 | |
| D. | 氧化鐵能與酸反應,可用于制作紅色涂料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該有機物屬于芳香烴 | |
| B. | 該物質不能使酸性高錳酸鉀溶液褪色 | |
| C. | 該分子對稱性好,所以沒有順反異構 | |
| D. | 該有機物分子中,最多可能有18個碳原子共平面 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X:氯化鋁溶液 Y:氨氣 | |
| B. | X:氫氧化鐵膠體 Y:氯化氫 | |
| C. | X:澄清石灰水 Y:二氧化碳 | |
| D. | X:四羥基合鋁酸鈉溶液 Y:氯化氫 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
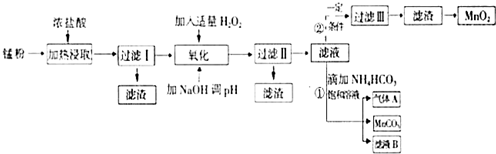 面對日益嚴重的環境問題,“變廢為寶”是化學發展的一個重要方向.例如用廢舊酸性鋅錳干電池經破碎后的錳粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸錳(MnCO3),工藝流程如圖所示:
面對日益嚴重的環境問題,“變廢為寶”是化學發展的一個重要方向.例如用廢舊酸性鋅錳干電池經破碎后的錳粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸錳(MnCO3),工藝流程如圖所示:| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀開始時PH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全時PH | 9.5 | 3.7 | 10.8 | 8.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 標準狀況下,22.4 L的H2O中含有的分子數為NA | |
| B. | 7.8g Na2S固體和7.8 g Na2O2固體中含有的陰離子數目均為0.1NA | |
| C. | 46克 Na與足量氧氣反應轉移的電子數為2NA | |
| D. | 1 L 1mol•L-1 Na2CO3溶液中含有的鈉離子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗 | 實驗目的 |
| A.測定等物質的量濃度的 CH3COONa和Na2S溶液pH | 比較 CH3COOH和H2S的酸性強弱 |
B.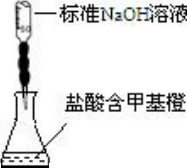 | 測定鹽酸的濃度 |
C.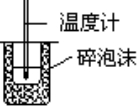 | 測定中和熱 |
| D.先用酚酞,后用甲基橙作指示劑,用標準鹽酸滴定0.1 mol/L的Na2CO3溶液 | 證明 CO32-水解分兩步 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com