
分析 (1)分子數目之比等于物質的量之比;
(2)摩爾質量以g/mol為單位,數值上等于其相對分子質量;
(3)根據V=nVm計算;
(4)電解質溶液中離子濃度=電解質濃度×化學式中離子數目,與溶液體積無關.
解答 解:(1)1molO2與1molO3分子數之比為1:1,故答案為:1:1;
(2)H2O的摩爾質量為18g/mol,故答案為:18;
(3)標準狀況下,0.1mol的氧氣的體積為0.1mol×22.4L/mol=2.24L,故答案為:2.24;
(4)2L0.5mol/LCaCl2溶液中Ca2+濃度1×0.5mol/L=0.5mol/L,故答案為:0.5.
點評 本題考查物質的量有關計算,比較基礎,注意對基礎知識的理解掌握.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
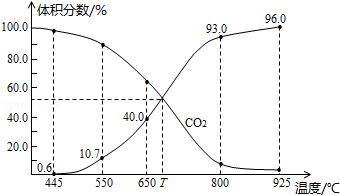
| A. | 550℃時,若充入惰性氣體,v正,v逆均減小 | |
| B. | 650℃時,反應達平衡后CO2的轉化率為25.0% | |
| C. | T℃時,若充入等體積的CO2和CO,平衡向逆反應方向移動 | |
| D. | 925℃時,用平衡分壓代替平衡濃度表示的化學平衡常數Kp=23.04P總 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
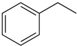 (g)→
(g)→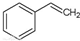 (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol; +CO(g)+H2O(g) △H=+158.8 kJ/mol
+CO(g)+H2O(g) △H=+158.8 kJ/mol
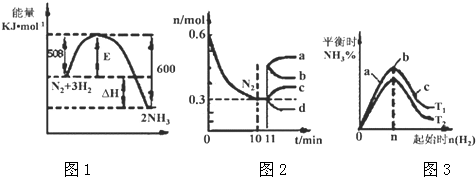
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ①②④⑤ | C. | ①②④⑤⑥ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 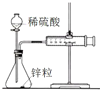 圖中測定鋅粒與1 mol/L稀硫酸反應速率,只需測定量筒中收集氫氣的體積 | |
| B. |  裝置中進行50 mL 0.50 mol/L鹽酸與50 mL 0.55 mol/L NaOH溶液測定中和熱,使溫度計溫度升高的熱量就是中和反應生成1 mol水的熱量 | |
| C. | 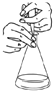 酸堿中和滴定中,可以在滴定過程中用少量水沖洗錐形瓶內壁以減小實驗誤差 | |
| D. |  滴定管中讀數為26.50mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 吸收208 kJ的熱量 | B. | 放出208 kJ的熱量 | ||
| C. | 吸收93 kJ的熱量 | D. | 放出93 kJ的熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,2.24L丙烷中含有的共用電子對數為NA | |
| B. | 25℃時,pH=1的鹽酸和醋酸溶液所含H+數均為0.1 NA | |
| C. | 利用雙氧水制氧氣,每生成1molO2轉移電子數為4 NA | |
| D. | 100mL 12mo1•L-1的濃鹽酸與足量MnO2加熱反應,生成C12分子數為0.3 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有Na2O | B. | 只有Na2O2 | C. | Na2O和Na2O2 | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2H2(g)+O2(g)═2H2O(g)△H=-480.4kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-240.2kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(g)△H=+480.4kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-480.4kJ/mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com