
| A. | 放出堿液的滴定管開始有氣泡,發出液體后氣泡消失 | |
| B. | 滴定管用蒸餾水洗滌后,直接注入標準酸液進行滴定 | |
| C. | 錐形瓶用蒸餾水洗滌后,直接加入待測溶液滴定 | |
| D. | 滴定管用蒸餾水洗滌后,直接注入待測液,取20.00 mL進行滴定 |
分析 根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析不當操作對V(標準)的影響,以此判斷濃度的誤差,據此解答.
解答 解:A.放出堿液的滴定管開始有氣泡,發出液體后氣泡消失,導致量取的待測液體積偏小,消耗的標準液體積偏小,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$可知溶液濃度偏低,故A不選;
B.滴定管用蒸餾水洗滌后,直接注入標準酸液進行滴定,都在標準液濃度降低,消耗的標準液體積偏大,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$可知溶液濃度偏高,故B選;
C.錐形瓶用蒸餾水洗滌后,直接加入待測溶液滴定,對消耗的標準液體積不產生影響,溶液濃度不變,故C不選;
D.滴定管用蒸餾水洗滌后,直接注入待測液,取20.00 mL進行滴定,導致待測液被稀釋,濃度降低,實際消耗的標準液體積偏小,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$可知溶液濃度偏低,故D不選;
故選:B.
點評 本題考查了中和滴定實驗誤差分析,準確判斷錯誤操作導致消耗標準液體積的影響是解題關鍵,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
 已知如表25℃時某些弱酸的電離平衡常數.如圖表示常溫時,稀釋CH3COOH、HClO兩種酸的稀溶液時,溶液pH隨加水量的變化.依據所給信息,下列說法正確的是( )
已知如表25℃時某些弱酸的電離平衡常數.如圖表示常溫時,稀釋CH3COOH、HClO兩種酸的稀溶液時,溶液pH隨加水量的變化.依據所給信息,下列說法正確的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A. | 如圖中的兩種酸分別和等濃度的NaOH溶液剛好完全反應,消耗堿的體積相等 | |
| B. | 向NaClO溶液中通入少量二氧化碳的離子方程式為:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | a、b、c三點所示溶液中水的電離程度c>a>b | |
| D. | 圖象中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液導電性:c>b>a |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| Na2S2O3起始讀數 | Na2S2O3 終點讀數 | |
| 第一次 | 0.10mL | 18.30mL |
| 第二次 | 0.30mL | 18.30mL |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

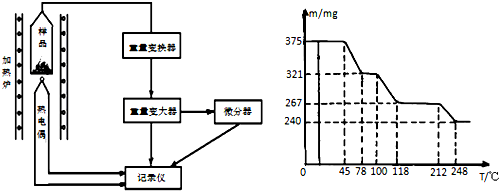
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
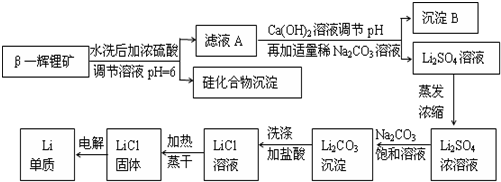
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
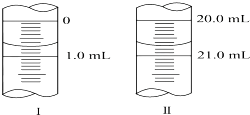 在分析化學中常用Na2C2O4晶體作為基準物質測定KMnO4溶液的濃度.在H2SO4溶液中,反應如下:
在分析化學中常用Na2C2O4晶體作為基準物質測定KMnO4溶液的濃度.在H2SO4溶液中,反應如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
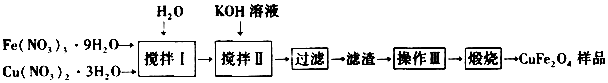
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com