
| Na2S2O3起始讀數 | Na2S2O3 終點讀數 | |
| 第一次 | 0.10mL | 18.30mL |
| 第二次 | 0.30mL | 18.30mL |
分析 根據實驗目的,含有一定量的Cr2O72-和CrO42-工業廢水,
步驟I:取25.00mL廢水,加入適量稀硫酸酸化,由于使CrO42-在酸性條件下轉化成Cr2O72-,所以加稀硫酸酸化是將使CrO42-盡可能的轉化成Cr2O72-;
步驟Ⅱ:由于Cr2O72-具有氧化性,加入過量的碘化鉀溶液,把Cr2O72-還原成三價鉻,而碘離子被氧化成碘單質;
步驟Ⅲ:用0.1000mol•L-1 Na2S2O3溶液滴定生成的碘單質,通過消耗的Na2S2O3溶液量來計算碘單質的量,再根據碘單質的量回頭計算Cr2O72-的量,從而達到實驗目的.
(1)含Cr2O72-的溶液呈橙色,含CrO42-的溶液呈黃色;
(2)根據以上分析,CrO42-在酸性條件下轉化成Cr2O72-,據此書寫Cr2O72-水解的離子方程式,判斷加入稀硫酸酸化的目的;
(3)根據Na2S2O3溶液顯堿性判斷;根據滴定碘單質應選用淀粉作指示劑;
(4)根據滴定達到終點時碘單質剛好被消耗分析;
(5)根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$,分析不當操作對V(標準)的影響,以此判斷濃度的誤差;
(6)根據Ⅳ將溶液中的三價鉻以沉淀的形式除去,符合綠色化學的思想分析.
解答 解:(1)含Cr2O72-的溶液呈橙色,含CrO42-的溶液呈黃色,故答案為:橙;黃;
(2)根據以上分析,CrO42-在酸性條件下轉化成Cr2O72-,所以Cr2O72-水解的離子方程式為Cr2O72-+H2O?2CrO42-+2H+,則根據平衡移動原理,加入稀硫酸酸化的目的使CrO42-盡可能的轉化成Cr2O72--,為步驟Ⅱ提供酸性環境,故答案為:Cr2O72-+H2O?2CrO42-+2H+;使CrO42-盡可能的轉化成Cr2O72--,為步驟Ⅱ提供酸性環境;
(3)因為Na2S2O3溶液顯堿性,所以Na2S2O3溶液應盛放在堿式滴定管;滴定碘單質應選用淀粉溶液作指示劑;故答案為:堿式滴定管;淀粉溶液;
(4)滴定達到終點時碘單質剛好被消耗,所以溶液的顏色由藍色變為無色,且在半分鐘內不變色,故答案為:溶液由藍色變為無色,且在半分鐘內不變色;
(5)根據Cr2O72-+6I-+14H +═2Cr3++3I2+7H2O和I2+2Na2S2O3═2NaI+Na2S4O6,則c(待測)偏高,Cr2O72-含量就偏高;
A.滴定終點讀數時,俯視滴定管的刻度,造成V(標準)偏小,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,測定c(待測)偏低,故A錯誤;
B.盛裝待測液的錐形瓶用蒸餾水洗過,未用待測液潤洗,對V(標準)無影響,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,測定c(待測)無影響,故B錯誤;
C.滴定到終點讀數時發現滴定管尖嘴處懸掛一滴溶液,造成V(標準)偏大,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,測定c(待測)偏高,故C正確;
D.未用標準液潤洗堿式滴定管,標準液的濃度偏小,造成V(標準)偏大,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,測定c(待測)偏高,故D正確;
故答案為:CD;
(6)Ⅳ的目的將溶液中的三價鉻以沉淀的形式除去,因為鉻離子使重金屬離子,會污染河水,所以在排入河流之前一定要除去三價鉻離子,故答案為:防止重金屬污染.
點評 本題考查了工業廢水中鉻的質量分數的測定,涉及到滴定實驗、誤差分析等,難度適中,理解滴定的原理是解題關鍵.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將純水加熱到95℃時,Kw變大,pH不變,水仍呈中性 | |
| B. | 向純水中加入稀氨水,平衡逆向移動,c(OH-)增大,Kw變小 | |
| C. | 向純水中加入少量氫氧化鈉固體,c(H+)減小,Kw不變 | |
| D. | 向純水中加入鹽酸,將抑制水的電離,Kw變小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 放出堿液的滴定管開始有氣泡,發出液體后氣泡消失 | |
| B. | 滴定管用蒸餾水洗滌后,直接注入標準酸液進行滴定 | |
| C. | 錐形瓶用蒸餾水洗滌后,直接加入待測溶液滴定 | |
| D. | 滴定管用蒸餾水洗滌后,直接注入待測液,取20.00 mL進行滴定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
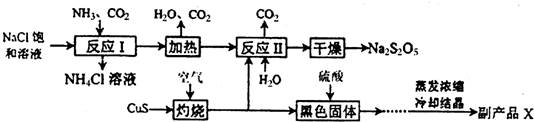
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知鉛蓄電池的工作原理為Pb+PbO2+2H2SO4$?_{充電}^{放電}$2PbSO4+2H2O,現用如圖裝置進行電解(電解液足量),測得當鉛蓄電池中轉移0.4mol電子時鐵電極的質量減少11.2g.請回答 下列問題.
已知鉛蓄電池的工作原理為Pb+PbO2+2H2SO4$?_{充電}^{放電}$2PbSO4+2H2O,現用如圖裝置進行電解(電解液足量),測得當鉛蓄電池中轉移0.4mol電子時鐵電極的質量減少11.2g.請回答 下列問題.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com