
| 4 |
| 8 |
| 0.4mol/L×0.4mol/L |
| (0.8mol/L)2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| ||||
| (2-x)2 |
| 1mol/L |
| 2mol/L |
| 1 |
| 2 |
| (1mol/L+0.5mol/L+0.5mol/L)×5L |
| (0.8mol/L+0.4mol/L+0.4mol/L)×5L |
| 2.8L |
| 22.4L/mol |


 名師指導期末沖刺卷系列答案
名師指導期末沖刺卷系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
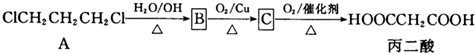
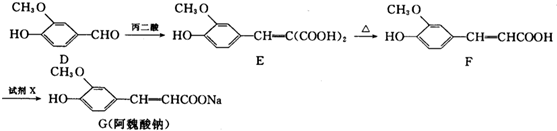
| 丙二酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:
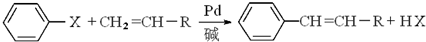 (X為鹵原子,R為取代基)
(X為鹵原子,R為取代基)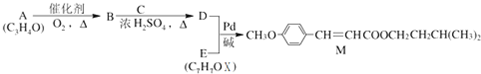
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| 選項 | 陳述Ⅰ | 陳述Ⅱ | 陳述Ⅲ |
| A | 加壓有利于提高SO2的轉化率 | 工業生產硫酸常在高溫下進行 | Ⅰ對,Ⅱ對;有 |
| B | Cl2和SO2混合后可用來漂白紙漿 | Cl2和SO2都有較好的漂白作用 | Ⅰ對,Ⅱ錯;無 |
| C | 工業生產硫酸用水吸收SO3 | SO3可與水反應 | Ⅰ對,Ⅱ對;有 |
| D | 石墨常用作電解池的電極 | 石墨的化學性質穩定且導電性好 | Ⅰ對,Ⅱ對;有 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 某溫度時,BaSO4在水中的沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq)Ksp=c(Ba2+)?c(SO42-),沉淀溶解平衡曲線如圖所示,下列說法正確的是( )
某溫度時,BaSO4在水中的沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq)Ksp=c(Ba2+)?c(SO42-),沉淀溶解平衡曲線如圖所示,下列說法正確的是( )| A、b點時c(Ba2+)?c(SO42- )小于Ksp |
| B、a點對應的Ksp等于c點對應的Ksp |
| C、加水稀釋可以使溶液由b點變到c點 |
| D、加入適量的Na2SO4不可能使溶液由a點變到c點 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com