


科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、①②③④ | B、③②①④ |
| C、④③①② | D、③②④① |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
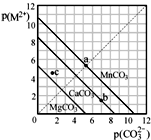 一定溫度下,三種碳酸鹽MCO3(M2+:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲線如圖所示.已知 p(M2+)=-lgc(M2+),p(CO32-)=-lgc(CO32-).下列說法正確的是( )
一定溫度下,三種碳酸鹽MCO3(M2+:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲線如圖所示.已知 p(M2+)=-lgc(M2+),p(CO32-)=-lgc(CO32-).下列說法正確的是( )| A、MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B、c點若表示MgCO3則為不飽和溶液,若表示CaCO3則有沉淀析出 |
| C、b點可表示CaCO3的飽和溶液,且Ca2+濃度與CO32-濃度相等 |
| D、在100mL MgCO3、CaCO3、MnCO3飽和的混和溶液中加入足量濃K2CO3溶液,產生沉淀MnCO3質量最多 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、向Ag2CrO4的濁液中加入AgNO3溶液,Ag2CrO4的Ksp減小 |
| B、將0.001 mol?L-1的AgNO3溶液逐滴加入到含Cl-和CrO42-濃度均為0.001 mol?L-1的溶液中,則先產生AgCl沉淀 |
| C、飽和AgCl溶液與飽和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| D、該溫度下,AgCl在水中的溶解度小于在食鹽水中的溶解度 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com