


科目:高中化學 來源: 題型:
| A、常溫常壓下,含NA個氧分子的氧氣的體積小于22.4L |
| B、2.24LCl2與足量Ca(OH)2反應,轉移的電子數為0.1NA |
| C、1mol CH3OH在燃料電池負極反應時轉移的電子數是6NA |
| D、100mL 18 mol/L濃硫酸與足量銅共熱,可生成SO2的分子數為0.9NA |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、向碳酸氫銨溶液中加入過量的NaOH固體 NH4++OH-=NH3↑+H2O |
| B、澄清的石灰水與稀鹽酸反應 Ca(OH)2+2H+=Ca2++2H2O |
| C、銅片插入硝酸銀溶液中 Cu+Ag+=Cu2++Ag |
| D、碳酸鈣溶于稀鹽酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、鍵長相同,兩個鍵之間夾角為109°28′ |
| B、N-H鍵為極性共價鍵 |
| C、4個N-H鍵的鍵能、鍵長相同 |
| D、N-H原子間存在配位鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:
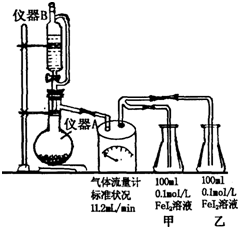 某研究性學習小組為探究Cl2的氧化性和I-的還原性強于Fe2+,設計了如圖裝置制取Cl2,并進行實驗探究.回答下列問題:
某研究性學習小組為探究Cl2的氧化性和I-的還原性強于Fe2+,設計了如圖裝置制取Cl2,并進行實驗探究.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:
| A、在AgBr飽和溶液中加入AgNO3溶液,達到平衡時,溶液中Br-濃度降低 |
| B、常溫下,pH=4的溶液一定是酸溶液 |
| C、FeCl3溶液和Fe2(SO4)3溶液加熱蒸干、灼燒都得到Fe2O3 |
| D、在滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,說明BaCl2溶液有酸性 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
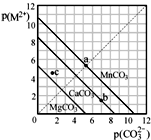 一定溫度下,三種碳酸鹽MCO3(M2+:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲線如圖所示.已知 p(M2+)=-lgc(M2+),p(CO32-)=-lgc(CO32-).下列說法正確的是( )
一定溫度下,三種碳酸鹽MCO3(M2+:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲線如圖所示.已知 p(M2+)=-lgc(M2+),p(CO32-)=-lgc(CO32-).下列說法正確的是( )| A、MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B、c點若表示MgCO3則為不飽和溶液,若表示CaCO3則有沉淀析出 |
| C、b點可表示CaCO3的飽和溶液,且Ca2+濃度與CO32-濃度相等 |
| D、在100mL MgCO3、CaCO3、MnCO3飽和的混和溶液中加入足量濃K2CO3溶液,產生沉淀MnCO3質量最多 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com