
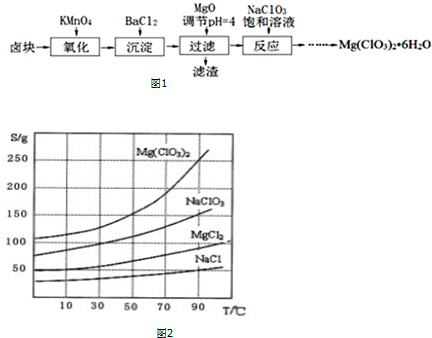
分析 鹵塊的成分有MgCl2•6H2O、MgSO4、FeCl2,加入高錳酸鉀之后,亞鐵離子可以被氧化為三價鐵離子,再向混合物中加入氯化鋇溶液,可以將硫酸根離子轉化為硫酸鋇沉淀,加入氧化鎂,調節pH=4,可以促進鐵離子的水解,將鐵離子轉化為氫氧化鐵而除去,過濾,得到的濾液是氯化鎂,濾渣有BaSO4和Fe(OH)3,根據溶解度曲線可知,混合溶液中NaCl溶解度最小,再加入NaClO3飽和溶液得到NaCl沉淀與Mg(ClO3)2溶液,經過蒸發濃縮、趁熱過濾、冷卻結晶、洗滌、干燥得到Mg(ClO3)2•6H2O;
(1)過濾實驗用到的儀器:漏斗、玻璃棒、燒杯、濾紙、鐵架臺等;加入MgO的作用是調節溶液的pH,使雜質Fe3+形成沉淀完全除去,前一步溶液中還生成硫酸鋇沉淀;
(2)硫酸根離子用鹽酸酸化的氯化鋇檢驗;
(3)向濾液中加入NaClO3飽和溶液后,發生反應MgCl2+2NaClO3=Mg(ClO3)2+2NaCl,然后利用NaCl、Mg(ClO3)2的溶解度與溫度的關系,將溶液蒸發濃縮、趁熱過濾、冷卻結晶、洗滌,得到Mg(ClO3)2•6H2O;
(4)①氯酸根離子具有氧化性,可以將亞鐵離子氧化為正三價;
②根據化學反應ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,根據各個質物之間的關系式可計算百分含量.
解答 解:鹵塊的成分有MgCl2•6H2O、MgSO4、FeCl2,加入高錳酸鉀之后,亞鐵離子可以被氧化為三價鐵離子,再向混合物中加入氯化鋇溶液,可以將硫酸根離子轉化為硫酸鋇沉淀,加入氧化鎂,調節pH=4,可以促進鐵離子的水解,將鐵離子轉化為氫氧化鐵而除去,過濾,得到的濾液是氯化鎂,濾渣有BaSO4和Fe(OH)3,根據溶解度曲線可知,混合溶液中NaCl溶解度最小,再加入NaClO3飽和溶液得到NaCl沉淀與Mg(ClO3)2溶液,經過蒸發濃縮、趁熱過濾、冷卻結晶、洗滌、干燥得到Mg(ClO3)2•6H2O;
(1)過濾實驗用到的儀器:漏斗、玻璃棒、燒杯、濾紙、鐵架臺等,其中玻璃儀器有:漏斗、玻璃棒、燒杯;
加入MgO的作用是調節溶液的pH=4,可以促進鐵離子的水解,使雜質Fe3+形成沉淀完全除去,所以加MgO后過濾所得濾渣的主要成分的化學式為Fe(OH)3,前一步中還生成硫酸鋇沉淀,所以濾渣成分為BaSO4和Fe(OH)3;
故答案為:漏斗、玻璃棒、燒杯;BaSO4和Fe(OH)3;
(2)硫酸根離子用鹽酸酸化的氯化鋇溶液檢驗,其檢驗方法為取過濾后濾液少許于試管中,滴加適量BaCl2溶液,若不再出現渾濁則SO42-已沉淀完全,
故答案為:取過濾后濾液少許于試管中,滴加適量BaCl2溶液,若不再出現渾濁則SO42-已沉淀完全;
(3)向濾液中加入NaClO3飽和溶液后,發生反應:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,然后利用NaCl、Mg(ClO3)2的溶解度與溫度的關系將溶液蒸發濃縮、趁熱過濾、冷卻結晶、洗滌,就得到Mg(ClO3)2•6H2O,
故答案為:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓;趁熱過濾;冷卻結晶;
(4)①氯酸根離子具有氧化性,可以將亞鐵離子氧化為正三價,化學方程式為:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案為:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
②根據化學方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100mol•L-1 K2Cr2O7溶液滴定至終點過程可以得出剩余的亞鐵離子的物質的量為:0.100mol•L-1×0.015L×6=0.009mol,和氯酸根離子反應的亞鐵離子的物質的量為:20×10-3L×1.000mol•L-1-0.009mol=0.011mol,
氯酸根離子的物質的量為:$\frac{1}{6}$×0.011mol,產品中Mg(ClO3)2•6H2O的質量分數:($\frac{1}{2}$×0.011×299g/mol)×10×$\frac{1}{3.5}$×100%=78.3%.
故答案為:78.3%.
點評 本題考查物質制備,為高頻考點,側重考查學生閱讀、獲取信息、利用信息解答問題、綜合知識靈活運用、計算能力,明確流程圖中發生的反應、各物質成分及其性質是解本題關鍵,涉及方程式的計算、儀器選取、實驗操作、氧化還原反應等知識點,注意正確確定(4)題各個物理量之間的關系式,題目難度中等.


 激活思維優加課堂系列答案
激活思維優加課堂系列答案 活力試卷系列答案
活力試卷系列答案 課課優能力培優100分系列答案
課課優能力培優100分系列答案科目:高中化學 來源: 題型:選擇題
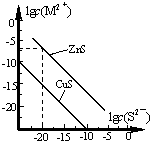 25℃時,用Na2S 沉淀Cu2+、Zn2+兩種金屬陽離子(M2+),所需S2-最低濃度的對數值lgc(S2-)與lgc(M2+)的關系如圖所示.下列說法不正確的是( )
25℃時,用Na2S 沉淀Cu2+、Zn2+兩種金屬陽離子(M2+),所需S2-最低濃度的對數值lgc(S2-)與lgc(M2+)的關系如圖所示.下列說法不正確的是( )| A. | Na2S 溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) | |
| B. | 25℃時,Ksp(CuS)約為1×10-35 | |
| C. | 向100 mL Zn2+、Cu2+濃度均為10-5 mol/L 的混合溶液中逐滴加入10-4mol/L 的Na2S 溶液,Cu2+先沉淀 | |
| D. | 向Cu2+濃度為10-5 mol/L 的工業廢水中加入ZnS 粉末,會有CuS 沉淀析出 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l);△H=-725.8kJ•mol-1 | |
| B. | 2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l);△H=+1451.6kJ•mol-1 | |
| C. | 2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l);△H=-22.68kJ•mol-1 | |
| D. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g);△H=-725.8kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 溴乙烷是一種重要的有機化工原料,其沸點為38.4℃.制備溴乙烷的一種方法是乙醇與氫溴酸反應,該反應的化學方程式是CH3CH2OH+HBr$→_{△}^{濃硫酸}$CH3CH2Br+H2O.
溴乙烷是一種重要的有機化工原料,其沸點為38.4℃.制備溴乙烷的一種方法是乙醇與氫溴酸反應,該反應的化學方程式是CH3CH2OH+HBr$→_{△}^{濃硫酸}$CH3CH2Br+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 研究硫酸工業原理及含硫化合物的性質具有重要意義.
研究硫酸工業原理及含硫化合物的性質具有重要意義.| 氣體 | SO2 | O2 | SO3 |
| 濃度(mol•L-1) | 0.4 | 1.2 | 1.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4L水中所含的分子數約為6.02×1023 | |
| B. | 標準狀況下,aL的氧氣和氮氣的混合物含有的分子數約為a/22.4×6.02×1023 | |
| C. | 常溫常壓下,48g O3氣體含有的氧原子數為6.02×1023 | |
| D. | 2.24L CO2中含有的原子數為0.3×6.02×1023 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com