
分析 (1)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19.3kJ/mol
依據蓋斯定律①×3-(③×2+②)得到:6CO(g)+6FeO(s)=6Fe(g)+6CO2(g)的△H,得到熱化學方程式.
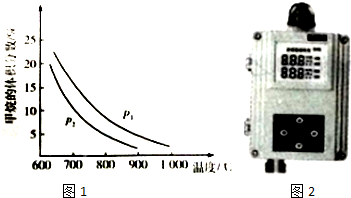
(2)①升高溫度,化學平衡向著吸熱方向進行,甲烷的體積分數減小;增加壓強,甲烷的體積分數增大,據此回答;
②在恒溫、恒壓的條件下,向上述平衡體系中通人氮氣,相當于體系減壓,所以平衡正向移動;
(3)①根據平衡常數表達式結合三行式計算化學平衡常數;轉化率等于變化量和初始量的比值;
(4)CO與O2反應生成CO2的燃料電池負極上是燃料燃燒的反應,據此回答.
解答 解:(1)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19.3kJ/mol
依據蓋斯定律①×3-(③×2+②)得到:6CO(g)+6FeO(s)=6Fe(g)+6CO2(g)△H=-66KJ/mol;得到熱化學方程式為:CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol,
故答案為:CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol;
(2)①壓強不變,升高溫度,化學平衡向著吸熱方向進行,甲烷的體積分數減小,所以正向進行,反應是吸熱的;溫度不變,增加壓強,甲烷的體積分數增大,所以P1大;故答案為:吸熱;<;
②在恒溫、恒壓的條件下,向上述平衡體系中通人氮氣,相當于體系減壓,所以平衡正向移動,故答案為:向正反應方向;
(3)CO+H2O(g)?CO2+H2,經過5min,反應達到平衡狀態,此時測得平均反應速率v(CO2)=0.01mol/(L•min),得到二氧化碳的變化濃度是0.05,
初始濃度:0.1 0.1 0 0
變化濃度:0.05 0.05 0.05 0.05
平衡濃度:0.05 0.05 0.05 0.05
化學平衡常數K=$\frac{0.05×0.05}{0.05×0.05}$=1,達到平衡時CO的轉化率為$\frac{0.05}{0.1}$×100%=50%;
故答案為:1;50%;
(4)CO與O2反應生成CO2的燃料電池負極上是燃料燃燒的反應,即CO+H2O-2e-=CO2+2H+,故答案為:CO+H2O-2e-=CO2+2H+.
點評 本題涉及熱化學、化學平衡的計算以及化學平衡的移動、電化學等方面的知識,屬于綜合知識的考查題,難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
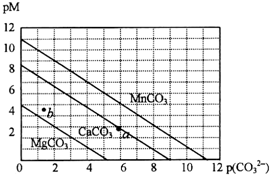 一定溫度下,三種碳酸鹽MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲線如下圖所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列說法正確的是( )
一定溫度下,三種碳酸鹽MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲線如下圖所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列說法正確的是( )| A. | M離子濃度越大,pM值越大 | |
| B. | MgCO3、CaCO3、MnCO3的Ksp依次增大 | |
| C. | b點表示MgCO3為不飽和溶液,若表示CaCO3則有沉淀析出 | |
| D. | a點可表示CaCO3的飽和溶液,且c(Ca2+)<c(CO32-) |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
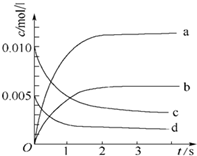 在2L密閉容器內,800℃時反應:2NO(g)+O2(g)?2NO2(g)體系中,n(NO)隨時間的變化如下表:
在2L密閉容器內,800℃時反應:2NO(g)+O2(g)?2NO2(g)體系中,n(NO)隨時間的變化如下表:| 時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
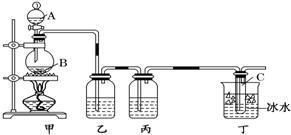
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
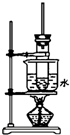 如圖是實驗室制取酚醛樹脂的裝置圖(燒杯底部墊有石棉網).
如圖是實驗室制取酚醛樹脂的裝置圖(燒杯底部墊有石棉網).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在常溫常壓下11.2 L氫氣所含的原子數目為NA | |
| B. | 18 g水所含的氫原子數目為NA | |
| C. | 2.3 g金屬鈉轉化為Na2O和Na2O2的混合物時失去的電子數為0.1NA | |
| D. | 物質的量濃度為0.5 mol•L-1 的MgCl2溶液,含有的Cl- 數為1 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 工業上電解熔融Al2O3制備金屬鋁 | |
| B. | 在海輪外殼上鑲入鋅塊,可減緩船體的腐蝕速率 | |
| C. | 金屬鋅與稀硫酸反應制取氫氣,粗鋅比純鋅反應速率快 | |
| D. | 電解MgCl2飽和溶液,可制得金屬鎂 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com