

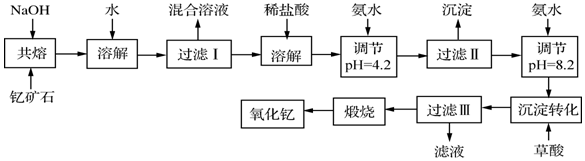
分析 鈦鐵礦石粉碎、凈化,凈化時加入濃NaOH溶液,發生的反應為Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O;然后向鈦鐵礦石中加入過量80%硫酸并加熱至343K-353K,發生反應2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O,FeO和硫酸反應生成FeSO4,加入X并調節溶液的pH得到沉淀和TiO2+、SO42-,說明加入X后將亞鐵離子氧化為鐵離子然后調節溶液pH值將鐵離子沉淀,然后將TiO2+、SO42-加熱、過濾得到TiO2.2H2O,焙燒得到TiO2.
(1)根據其價電子數及能層數確定在元素周期表中的位置,Ti元素核外有22個電子,根據構造原理書寫其基態原子核外電子排布式;氧化亞鐵和硫酸反應生成硫酸亞鐵,不需要除去雜質FeO;
(2)兩性氧化物是氧化鋁,和NaOH溶液反應生成鹽和水;
(3)④X應該具有強氧化性,且不能引進雜質;
(4)④⑤兩步的目的是除去亞鐵離子;
(5)⑥中TiO2+水解生成TiO2•2H2O;
(6)陰極上得電子反應還原反應生成金屬鈦;
(7)陽極上氧離子失電子生成氧氣,氧氣和C反應生成二氧化碳;用△H-T△S來判斷反應能否發生.
解答 解:(1)Ti元素核外有22個電子,根據構造原理知其基態原子核外電子排布式為1s22s22p63S23p63d24s2(或[Ar]3d24s2),該元素的能層數為4、價電子數為4,所以鈦元素位于第四周期第IVB族,氧化亞鐵和硫酸反應生成硫酸亞鐵,所以凈化鈦礦石時,不需要除去雜質FeO,
故答案為:第四周期IVB族;不需要;
(2)兩性氧化物是氧化鋁,和NaOH溶液反應生成鹽和水,離子反應方程式為Al2O3+2OH-=2AlO2-+H2O,
故答案為:Al2O3+2OH-=2AlO2-+H2O;
(3)④X應該具有強氧化性,且不能引進雜質,具有氧化性的是雙氧水和高錳酸鉀溶液,但高錳酸鉀溶液氧化亞鐵離子時引進新的雜質,所以故選A;
故答案為:A;
(4)④⑤兩步的目的是除去亞鐵離子,防止制得的二氧化鈦中含有雜質,
故答案為:除去亞鐵離子;
(5)⑥中TiO2+水解生成TiO2.2H2O,反應方程式為TiOSO4+3H2O=TiO2•2H2O↓+H2SO4,
故答案為:TiOSO4+3H2O=TiO2•2H2O↓+H2SO4;
(6)陰極上得電子反應還原反應生成金屬鈦,電極反應式為TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti),
故答案為:TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti);
(7)陽極上氧離子失電子生成氧氣,氧氣和C反應生成二氧化碳,所以需要定期補充碳,TiO2(s)+2Cl2(g)?TiCl4(1)+O2(g)△H=+151kJ/mol該反應中,反應物有2mol氣體,生成物只有1mol氣體,△S<0,又△H>0,則△H-T△S>0,故反應不能自發進行,
故答案為:碳單質會與陽極產生的氧氣反應而不斷減少;該反應的△H>0,△S<0,反應難自發進行.
點評 本題考查物質的分離提純和制備,為高頻考點,側重考查學生對化學工藝流程的理解、分析、判斷及對知識的綜合運用能力,涉及除雜、氧化還原反應、電解原理、反應的方向判斷等知識點,明確化學反應原理、元素化合物性質是解本題關鍵,易錯點是(6)題電極反應式的書寫,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 元素從化合態變為游離態,該元素一定被還原 | |
| B. | 鋁合金比純鋁的熔點更高 | |
| C. | 保存FeCl3溶液時,通常在溶液中加少量的單質鐵 | |
| D. | 漂白粉應隔絕空氣密封保存 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 純水100℃和25℃的pH值 | |
| B. | 氫硫酸溶液中的H+和HS-的濃度 | |
| C. | 100mL0.1mol/L的CH3COOH溶液與10mL1.0mol/L的CH3COOH溶液中H+數目 | |
| D. | 25℃,pH=11的KOH溶液與pH=3的CH3COOH溶液中由水電離出的OH-離子濃度 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3 •H2O | B. | Na2CO3 •2H2O | C. | Na2CO3 | D. | 無法計算 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ;當溫度過高時,尾氣中有毒氣體的含量會升高,原因是CO2+C$\frac{\underline{\;高溫\;}}{\;}$2CO(用化學方程式表示).
;當溫度過高時,尾氣中有毒氣體的含量會升高,原因是CO2+C$\frac{\underline{\;高溫\;}}{\;}$2CO(用化學方程式表示).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 離子 | 開始沉淀時的pH | 完全沉淀時的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 取樣,加少量AgNO3溶液,有白色沉淀;再加稀硝酸,看白色沉淀是否消失 | |
| B. | 取樣,先加鹽酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| C. | 取樣,先加稀硫酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| D. | 取樣,滴加AgNO3溶液,看是否有白色沉淀生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向某溶液中先滴加氯水,再滴加KSCN溶滾,溶液顯血紅色,說明原溶液中含有Fe3+ | |
| B. | 向某溶液中滴加過量氨水,先有白色沉淀產生,然后沉淀溶解,說明原溶液中含有Al3+ | |
| C. | 向某溶液中滴加Ca(OH)2溶液,得到白色沉淀,說明原溶液中含有CO32- | |
| D. | 向某溶液中滴加過量NaOH溶液,得到藍色沉淀,說明原溶液中含有Cu2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 | |
| 腐蝕快慢 | 較快 | 慢 | 較快 | |||||
| 主要產物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | ||||
| A. | 隨pH的升高,碳鋼腐蝕速率逐漸加快 | |
| B. | pH<4,發生析氫腐蝕 | |
| C. | pH為14,其負極反應為2H2O+Fe_3e-═FeO2-+4H+ | |
| D. | pH為7時,負極反應為Fe_3e-═Fe3+,生成的Fe3+被空氣中的氧氣氧化為Fe2O3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com