

 ;當溫度過高時,尾氣中有毒氣體的含量會升高,原因是CO2+C$\frac{\underline{\;高溫\;}}{\;}$2CO(用化學方程式表示).
;當溫度過高時,尾氣中有毒氣體的含量會升高,原因是CO2+C$\frac{\underline{\;高溫\;}}{\;}$2CO(用化學方程式表示).分析 重晶石和煤粉碎后煅燒粉碎反應生成硫化鋇、二氧化碳,尾氣主要是一氧化碳,反應后的固體浸取后通入二氧化碳預碳化,加入硫氫化鋇溶液反應生成碳酸鋇沉淀和硫化氫氣體,碳酸鋇脫硫后過濾干燥得到碳酸鋇產品,
(1)碳酸鋇粉碎后煅燒和碳反應生成硫化鋇和二氧化碳,氧化產物為二氧化碳,二氧化碳中存在兩個碳氧雙鍵,屬于共價化合物,當溫度過高時,尾氣中有毒氣體的含量會升高是高溫下碳和二氧化碳反應生成有毒氣體一氧化碳;
(2)提高浸取速率可以升溫、攪拌、粉碎增大接觸面積等措施;
(3)碳化時Ba(HS)2和二氧化碳氣體發(fā)生反應生成碳酸鋇沉淀和硫化氫氣體;
(4)根據(jù)化學平衡常數(shù)為生成物的濃度冪之積與反應物的濃度冪之積之比列式,代入Ksp計算;
(5)Ba(HS)2溶液中溶質是強堿弱酸鹽,HS-離子水解程度大于其電離程度溶液顯堿性,溶液中存在電荷守恒;
(6)鋇餐的主要成分是硫酸鋇,硫酸鋇難電離,在溶液中不能電離出有毒的鋇離子,不會使人體中毒;碳酸鋇能與稀鹽酸反應生成可溶性的氯化鋇,氯化鋇能電離出有毒鋇離子.
解答 解:(1)碳酸鋇粉碎后煅燒和碳反應生成硫化鋇和二氧化碳,反應的化學方程式為:BaSO4+2C$\frac{\underline{\;高溫\;}}{\;}$BaS+2CO2↑,反應中碳元素化合價升高失電子做還原劑被氧化得到氧化產物二氧化碳,二氧化碳中存在兩個碳氧雙鍵,屬于共價化合物,電子式為: ,高溫下碳和二氧化碳反應生成有毒氣體一氧化碳:CO2+C$\frac{\underline{\;高溫\;}}{\;}$2CO;
,高溫下碳和二氧化碳反應生成有毒氣體一氧化碳:CO2+C$\frac{\underline{\;高溫\;}}{\;}$2CO;
故答案為:BaSO4+2C$\frac{\underline{\;高溫\;}}{\;}$BaS+2CO2↑; ;CO2+C$\frac{\underline{\;高溫\;}}{\;}$2CO;
;CO2+C$\frac{\underline{\;高溫\;}}{\;}$2CO;
(2)提高浸取速率可以升溫、攪拌、粉碎增大接觸面積等措施;
故答案為:適當提高溫度(或攪拌等);
(3)碳化時Ba(HS)2和H2S氣體粉碎反應生成碳酸鋇沉淀和硫化氫氣體,反應的離子方程式為:CO2+H2O+Ba2++2HS-=BaCO3↓+H2S↑;
故答案為:CO2+H2O+Ba2++2HS-=BaCO3↓+2H2S↑;
(4)CO32-+BaS2O3═BaCO3+S2O32-,該反應的平衡常數(shù)K=$\frac{c({S}_{2}{{O}_{3}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c({S}_{2}{{O}_{3}}^{2-})•c(B{a}^{2+})}{c(C{{O}_{3}}^{2-})•c(B{a}^{2+})}$$\frac{Ksp(Ba{S}_{2}{O}_{3})}{Ksp(BaC{O}_{3})}$=$\frac{1.6×1{0}^{-5}}{2.5×1{0}^{-9}}$=6.4×103;
故答案為:6.4×103;
(5)Ba(HS)2溶液中溶質是強堿弱酸鹽,HS-離子水解程度大于其電離程度溶液顯堿性,溶液中離子濃度大小為:c(HS-)>c(Ba2+)>c(OH-)>c(H+)>c(S2-),溶液中存在電荷守恒2c(Ba2+)+c(H+)=c(HS-)+2c(S2-)+c(OH-);
故答案為:c(HS-)>c(Ba2+)>c(OH-)>c(H+)>c(S2-);2c(Ba2+)+c(H+)=c(HS-)+2c(S2-)+c(OH-);
(6)碳酸鋇與稀鹽酸反應生成氯化鋇、水和二氧化碳,該反應的化學方程式為:BaCO3+2HCl=BaCl2+CO2↑+H2O,BaCO3與胃酸中的鹽酸反應生成可溶性的重金屬鹽氯化鋇會使人中毒;
故答案為:BaCO3 與胃酸中的鹽酸反應生成可溶性的重金屬鹽BaCl2,會使人中毒.
點評 本題考查了物質制備工藝流程分析,主要是程度溶解平衡常數(shù)計算、電解質溶液中離子濃度大小比較、電荷守恒等知識點,掌握基礎是解題關鍵,題目難度中等.


 學期復習一本通學習總動員期末加暑假延邊人民出版社系列答案
學期復習一本通學習總動員期末加暑假延邊人民出版社系列答案科目:高中化學 來源: 題型:解答題
 本月4日,谷歌公司宣布:以60勝O負1平的戰(zhàn)績橫掃眾多圍棋高手的神秘棋手“Master”乃是其人工智能產品AlpbaGo的升級版,人工智能再次成為熱門話題.其中,高純度硅是一種重要的基礎材料.以下是工業(yè)上制取純硅的一種方法:
本月4日,谷歌公司宣布:以60勝O負1平的戰(zhàn)績橫掃眾多圍棋高手的神秘棋手“Master”乃是其人工智能產品AlpbaGo的升級版,人工智能再次成為熱門話題.其中,高純度硅是一種重要的基礎材料.以下是工業(yè)上制取純硅的一種方法:查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | S2-、K+、NO3-、SO42- | B. | H+、Na+、HCO3-、SO42- | ||
| C. | NH4+、Al3+、NO3-、Cl- | D. | Na+、K+、S2O32-、F- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學反應過程中的能量變化除了熱能外,還可以是光能、電能等 | |
| B. | 放熱反應的△H<0 | |
| C. | 需要加熱才能發(fā)生反應一定是吸熱反應 | |
| D. | 反應物的總能量低于生成物的總能量時,發(fā)生吸熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 裝鹽酸的滴定管用蒸餾水洗干凈后立即裝入鹽酸 | |
| B. | 滴加鹽酸時滴到錐形瓶外 | |
| C. | 滴定達到終點時,振蕩時待測液濺出錐形瓶 | |
| D. | 滴定前裝鹽酸的滴定管有氣泡,滴定后氣泡消失 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在該溫度下平衡常數(shù)K=1 | |
| B. | 平衡時通入CO氣體,則再次達平衡時,H2O的轉化率增大.而CO的轉化率減小 | |
| C. | 平衡時CO的體積分數(shù)為25% | |
| D. | 平衡常數(shù)與反應溫度無關 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
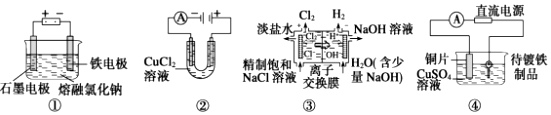
| A. | 裝置①工業(yè)上可用于生產金屬鈉,電解過程中石墨電極產生金屬 | |
| B. | 裝置②中陽極產生的氣體可以使?jié)駶櫟牡矸鄣饣浽嚰堊兯{ | |
| C. | 裝置③中的離子交換膜允許陽離子、陰離子和小分子水通過 | |
| D. | 裝置④的待鍍鐵制品應與電源正極相連 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 實驗I:實驗室制備氨氣 | |
| B. | 實驗Ⅱ:用二氧化碳作噴泉實驗 | |
| C. | 實驗Ⅲ:進行中和熱的測定 | |
| D. | 實驗Ⅳ:電解氯化銅溶液得到銅和氯氣 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com