
| 化學式 | 電離常數(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
分析 (1)純水在T℃時,pH=6,說明此時水的離子積常數為10-12,該溫度下1mol•L-1的NaOH溶液中,氫離子由水電離產生,所以c(H+)=$\frac{1{0}^{-12}}{1}$mol/L,而水電離出的c(OH-)=c(H+)=10-12mol•L-1;
(2)加水稀釋弱酸時,會促進弱酸的電離;依據中和反應中消耗的氫離子的物質的量等于氫氧根離子的物質的量解答;
(3)0.1mol•L-1H2A溶液,H2A=H++HA-,電離出H+為0.1mol/L,而0.1mol•L-1NaHR溶液的c(H+)=a mol•L-1,則由HA-?H++A2-可知,電離出0.1mol/LH+,對第一步電離生成的H+抑制了HA-的電離;
(4)①根據酸的電離常數進行分析判斷,電離常數越大,pH越小;
②向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>HCO3-,故反應生成HCN和碳酸氫鈉,不能生成二氧化碳,故反應的化學方程式為NaCN+H2O+CO2=HCN+NaHCO3.
解答 解:(1)純水在T℃時,pH=6,說明此時水的離子積常數為10-12,該溫度下1mol•L-1的NaOH溶液中,氫離子由水電離產生,所以c(H+)=$\frac{1{0}^{-12}}{1}$mol/L,而水電離出的c(OH-)=c(H+)=10-12mol•L-1,故答案為:10-12;
(2)某一元弱酸溶液(A)與二元強酸(B)的pH相等,則弱酸有大部分為電離,加水稀釋時,能夠促進更多的弱酸電離,所以加水稀釋后,氫離子濃度大于二元強酸中氫離子濃度,所以pHA<pHB,
上述稀釋溶液中弱酸的氫離子的物質的量濃度大于強酸,所以等體積含有的氫離子的物質的量多,中和等濃度等體積的NaOH溶液,用的體積少,
故答案為:<,<;
(3)0.1mol•L-1H2A溶液,H2A=H++HA-,電離出H+為0.1mol/L,而0.1mol•L-1NaHR溶液的c(H+)=a mol•L-1,則由HA-?H++A2-可知,電離出0.1mol/LH+,對第一步電離生成的H+抑制了HA-的電離,所以0.1mol•L-1H2R溶液中c(H+)<(0.1+a) mol•L-1,故答案為:<;H2R中第一步電離出的H+對HR-的電離產生了抑制作用;
(4)①根據酸的電離常數進行分析判斷,電離常數越大,pH越小,根據圖表數據分析,電離常數:醋酸>HCN>碳酸氫根離子,所以三溶液的pH由大到小的順序為H2CO3>HCN>CH3COOH,故答案為:H2CO3>HCN>CH3COOH;
②向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>HCO3-,故反應生成HCN和碳酸氫鈉,不能生成二氧化碳,故反應的化學方程式為NaCN+H2O+CO2=HCN+NaHCO3,
故答案為:NaCN+H2O+CO2=HCN+NaHCO3.
點評 本題考查鹽類水解的應用,溶液中離子濃度的大小比較,綜合性較強.要注意碳酸是二元弱酸分步電離,第二部電離比HCN小.


科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,3.2g O 2所含的原子數為0.2NA | |
| B. | 標準狀況下,18g H2 O所含的氧原子數目為NA | |
| C. | 常溫常壓下,92g NO2和N2O 4的混合氣體中含有的原子總數為6 NA | |
| D. | 標準狀況下,22.4LCH4與22.4L N2所含原子數均為2 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.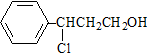 $→_{△}^{O_{2}/Cu}$$→_{Ⅱ}^{一定條件}$乙
$→_{△}^{O_{2}/Cu}$$→_{Ⅱ}^{一定條件}$乙 ,設計步驟Ⅰ的目的是保護碳碳雙鍵,防止被氧化.
,設計步驟Ⅰ的目的是保護碳碳雙鍵,防止被氧化.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增大反應物濃度可以增大活化分子百分數,從而使反應速率增大 | |
| B. | 汽車尾氣的催化轉化裝置可將尾氣中的NO和CO等有害氣體快速地轉化為N2和CO2,其原因是催化劑可增大NO和CO反應的活化能 | |
| C. | 常溫下,反應C(s)+CO2(g)═2CO(g)不能自發進行,則該反應的△H>0 | |
| D. | 在“中和熱的測量實驗”中測定反應后溫度的操作方法:將量筒中的NaOH溶液經玻璃棒引流緩緩倒入盛有鹽酸的簡易量熱計中,立即蓋上蓋板,并用環形玻璃攪拌棒不斷攪拌,準確讀出并記錄反應體系的最高溫度 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
| 實驗 | 溫度/℃ | 起始量] | 達到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO轉化率 | 所需時間/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | 25% | 3 | |
| 3 | 900 | a | b | c | t | |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 為紀念化學學科所取得的成就以及對人類文明的貢獻,聯合國將2011年定為“國際化學年”,其主題為“化學──我們的生活,我們的未來”.化學關注食品安全、人類健康和社會的可持續發展,為改善人類生活質量、提高人類生活水平發揮了重要作用.請回答下列問題:
為紀念化學學科所取得的成就以及對人類文明的貢獻,聯合國將2011年定為“國際化學年”,其主題為“化學──我們的生活,我們的未來”.化學關注食品安全、人類健康和社會的可持續發展,為改善人類生活質量、提高人類生活水平發揮了重要作用.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 陳述Ⅰ | 陳述Ⅱ | |
| A | 漂白粉在空氣中久置變質 | 漂白粉中的CaCl2與空氣中的CO2反應生成CaCO3 |
| B | 非金屬性:Cl>S | 酸性:HClO3>H2SO4 |
| C | 常溫下,NaHCO3的溶解度比Na2CO3小 | 向飽和Na2CO3溶液中通入CO2產生沉淀 |
| D | 常溫下,SO2與氫硫酸和NaOH溶液均可反應 | SO2是兩性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe3+、Na+、Cl-、OH- | B. | Fe3+、Cl-、K+、Ca2+ | ||
| C. | Cl-、Ca2+、Mg2+、CO32- | D. | Ba2+、K+、CO32-、Cl- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com