
 為紀念化學學科所取得的成就以及對人類文明的貢獻,聯合國將2011年定為“國際化學年”,其主題為“化學──我們的生活,我們的未來”.化學關注食品安全、人類健康和社會的可持續發展,為改善人類生活質量、提高人類生活水平發揮了重要作用.請回答下列問題:
為紀念化學學科所取得的成就以及對人類文明的貢獻,聯合國將2011年定為“國際化學年”,其主題為“化學──我們的生活,我們的未來”.化學關注食品安全、人類健康和社會的可持續發展,為改善人類生活質量、提高人類生活水平發揮了重要作用.請回答下列問題:分析 (1)維生素既不參與構成人體細胞,也不為人體提供能量,而且人體對它的需要量很小,但它對人體的各項生命活動有重要的作用;人體如果缺乏維生素A會患夜盲癥;缺維生素C會患壞血病、抵抗力下降,缺維生素D會患佝僂病、骨質疏松,據此解答;
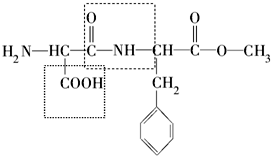
(2)根據阿司巴甜的結構簡式可以判斷阿司巴甜分子中虛線框內官能團的名稱為肽鍵和羧基;
(3)缺乏蛋白質患營養缺乏癥;肉類食物中含有蛋白質;
(4)為預防碘缺乏病,可以向食鹽中添加KIO3作為營養強化劑來補碘;碳酸氫鈉受熱分解生成二氧化碳氣體可以作為疏松劑;
(5)鋼筋混凝土屬于復合材料,玻璃屬于無機非金屬材料,制造玻璃的主要原料為純堿、石灰石和石英;鋁與空氣中的氧氣發生反應在其表面生成一層致密的氧化膜保護鋁進一步被腐蝕;光導纖維的主要成分是SiO2.
解答 解:(1)能防治夜盲癥的是維生素A,能預防佝僂病的是維生素D,能防治壞血病的是維生素C,故答案為:④;①;
(2)由阿司巴甜的結構簡式,則阿司巴甜分子中虛線框內官能團的名稱為肽鍵和羧基,故答案為:肽鍵;羧基;
(3)缺乏蛋白質會導致生長發育出現障礙,患營養缺乏癥;肉類食物中富含蛋白質,所以瘦肉中含有豐富的蛋白質,
故答案為:蛋白質;C;
(4)為預防碘缺乏病,可以向食鹽中添加KIO3作為營養強化劑來補碘;碳酸氫鈉受熱分解生成二氧化碳氣體可以作為疏松劑,方程式為:2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;故答案為:KIO3;2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(5)鋼筋混凝土屬于復合材料,玻璃屬于無機非金屬材料,制造玻璃的主要原料為純堿、石灰石和石英;因為鋁與空氣中的氧氣發生反應在其表面生成一層致密的氧化膜保護鋁進一步被腐蝕,所以鋁在空氣中卻比鐵表現出良好的抗腐蝕性;光導纖維的主要成分是SiO2.
故答案為:復合材料;無機非金屬;純堿;鋁與空氣中的氧氣發生反應在其表面生成一層致密的氧化膜;SiO2.
點評 本題考查較為綜合,側重于營養物質、材料以及醫藥等角度的考查,為高考常見題型,有利于培養學生的良好的科學素養,提高學習的積極性,難度不大,注意化學在生產和生活中的實際應用是重點.


科目:高中化學 來源: 題型:選擇題
| A. | SO2、SiO2、CO均為酸性氧化物 | B. | 稀豆漿、硅酸、氯化鐵溶液均為膠體 | ||
| C. | 鹽酸、水玻璃、氨水均為混合物 | D. | 燒堿、冰醋酸、四氯化碳均為電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 編號 | 反應溫度/℃ | Na2S2O3濃液/mL | 甲 | 0.1mol/LH2SO4溶液/mL | 乙 |
| ① | 25℃ | 10.0 | 0 | 10.0 | |
| ② | 25℃ | 5.0 | a | 10.0 | |
| ③ | 45℃ | 10.0 | 0 | 10.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 化學式 | 電離常數(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 氨在生活、生產、科研中有廣泛用途.
氨在生活、生產、科研中有廣泛用途.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化鐵和鹽酸:O2-+2H+═H2O | |
| B. | 向澄清石灰水中通入過量的CO2:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| C. | 澄清石灰水和Ca(HCO3)2溶液反應:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 氫氧化鋇溶液和硫酸鎂溶液反應:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
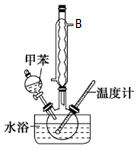 硝基甲苯有領、間、對三種,其中對硝基甲苯是醫藥、染料等工業的一種重要有機中間體,它常以濃硝酸為硝化劑,濃硫酸為催化劑,通過甲苯的硝化反應制備.一種新的制備對硝基甲苯的實驗方法是:以發煙硝酸為硝化劑,固體NaHSO4為催化劑(可循環使用),在CCl4溶液中,加入乙酸酐(有脫水作用),45℃反應1h.反應結束后,過濾,濾液分別用5%NaHCO3,溶液、水洗至中性,再經分離提純得到對硝基甲苯.
硝基甲苯有領、間、對三種,其中對硝基甲苯是醫藥、染料等工業的一種重要有機中間體,它常以濃硝酸為硝化劑,濃硫酸為催化劑,通過甲苯的硝化反應制備.一種新的制備對硝基甲苯的實驗方法是:以發煙硝酸為硝化劑,固體NaHSO4為催化劑(可循環使用),在CCl4溶液中,加入乙酸酐(有脫水作用),45℃反應1h.反應結束后,過濾,濾液分別用5%NaHCO3,溶液、水洗至中性,再經分離提純得到對硝基甲苯.| 催化劑 | n(催化劑) | 硝化產物中各種異構體質量分數(%) | 總產率 (%) | ||
| n(甲苯) | 對硝基甲苯 | 鄰硝基甲苯 | 間硝基甲苯 | ||
| 濃H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 82.0 |
| 1.2 | 36.5 | 59.2 | 4.0 | 83.8 | |
NaHSO4 | 0.25 | 46.3 | 52.8 | 0.9 | 92.8 |
| 0.32 | 48.0 | 51.7 | 0.3 | 95.0 | |
| 0.36 | 45.0 | 54.4 | 0.6 | 93.9 | |
| 密度/g•cm-3 | 沸點/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 對硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液態烴 |
| 鄰硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液態烴 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 未冷卻就轉移、定容 | B. | 容量瓶內原有少量蒸餾水 | ||
| C. | 定容時俯視刻度線觀察液面 | D. | 定容時加多了水再用吸管吸出 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com