
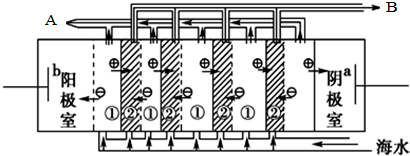
 電滲析法淡化海水時陰極室可獲得的重要化工原料有氫氣、氫氧化鈉.
電滲析法淡化海水時陰極室可獲得的重要化工原料有氫氣、氫氧化鈉.| CaSO4 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
分析 (1)在電滲析法淡化海水示意圖中陰離子移向陽極,陽離子移向陰極,則水中的氫離子在陰極放電;
(2)海水曬鹽需要濃縮、蒸發、結晶;建鹽田必須在陽光充足、平坦空曠的地方;
(3)①檢測Fe3+是否除盡,選擇KSCN試劑觀察是否出現血紅色;
②過程I除去鋇離子,由表格數據可知硫酸鋇比碳酸鋇更難溶;
(4)制取純堿,第一步中NaCl、CO2 和 NH3 為原料反應生成碳酸氫鈉和氯化銨;
(5)測定樣品中NaCl的質量分數,由流程可知,固體ng為碳酸鋇的質量,
①檢驗沉淀是否洗滌干凈,可檢驗最后一次的洗滌液是否含鋇離子或氯離子;
②由ngBaCO3~Na2CO3計算碳酸鈉的質量,再計算NaCl質量分數.
解答 解:(1)在電滲析法淡化海水示意圖中陰離子移向陽極,陽離子移向陰極,則水中的氫離子在陰極放電,則陰極生成氫氣,同時生成NaOH,故答案為:氫氣、氫氧化鈉;
(2)海水曬鹽需要濃縮、蒸發、結晶,則鹽田分為貯水池、蒸發池和結晶池;建鹽田必須在陽光充足、平坦空曠的地方,則選B.多風少雨、C.潮汐落差大且又平坦空曠的海灘,與A無關,故答案為:蒸發;BC;
(3)①檢測Fe3+是否除盡的方法為取過程 III的濾液于試管中,向其中滴加KSCN溶液,若溶液不變色證明Fe3+已經沉淀干凈,反之沒除凈,故答案為:取過程 III的濾液于試管中,向其中滴加KSCN溶液,若溶液不變色證明Fe3+已經沉淀干凈,反之沒除凈;
②過程I除去鋇離子,由表格數據可知硫酸鋇比碳酸鋇更難溶,則選用BaCl2而不選用CaCl2的原因為BaSO4的溶解度比CaSO4的更小,可將SO42-沉淀的更完全,故答案為:BaSO4的溶解度比CaSO4的更小,可將SO42-沉淀的更完全;
(4)制取純堿,第一步中NaCl、CO2 和 NH3 為原料反應生成碳酸氫鈉和氯化銨,該反應為NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,故答案為:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
(5)測定樣品中NaCl的質量分數,由流程可知,固體ng為碳酸鋇的質量,
①檢驗沉淀是否洗滌干凈的方法為取最后一次洗滌液于試管中,加入稀H2SO4溶液(或AgNO3(HNO3)溶液),若產生白色沉淀,則沉淀沒有洗滌干凈;若無白色沉淀,則沉淀已洗滌干凈,故答案為:取最后一次洗滌液于試管中,加入稀H2SO4溶液(或AgNO3(HNO3)溶液),若產生白色沉淀,則沉淀沒有洗滌干凈;若無白色沉淀,則沉淀已洗滌干凈;
②由BaCO3~Na2CO3可知碳酸鈉的質量為$\frac{106n}{197}$g,則樣品中NaCl質量分數為$\frac{m-\frac{106n}{197}}{m}$×100%=(1-$\frac{106n}{197m}$)×100%,故答案為:(1-$\frac{106n}{197m}$)×100%.
點評 本題考查較綜合,涉及海水資源利用、含量測定及計算、混合物分離提純等,側重分析、推斷、計算能力的綜合考查,為高考中常見的考查方式,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 醋酸溶液與水垢中的CaCO3反應:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | NH4HCO3溶于過量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 將氯氣溶于水制備次氯酸:Cl2+H2O═2H++Cl-+ClO- | |
| D. | Fe3O4溶于足量濃鹽酸:Fe3O4+8H+═Fe2++2Fe3++4H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+、Al3+、NO3-、HCO3- | B. | H+、Na+、Fe2+、ClO- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | K+、NH4+、SO42-、OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4.6g 金屬鈉與足量乙醇反應放出2.24L氫氣 | |
| B. | 50mL 18.4 mol/L濃硫酸與足量銅加熱反應,生成SO2分子的數目為0.46NA | |
| C. | 1mol羥基(-OH)中含電子數為10NA | |
| D. | 常溫下,10L pH=12的Na2CO3溶液中含有的OH-離子數目為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 液氨汽化時吸收大量的熱,可用作制冷劑 | |
| B. | 硅酸鈉溶液呈堿性,可用作木材防火劑 | |
| C. | NaHCO3能與堿反應,可用作焙制糕點的膨松劑 | |
| D. | Fe比Cu活潑,可用FeCl3溶液腐蝕線路板上的Cu |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | SiO2(s)+2C(s)═Si(s)+2CO(g)只能在高溫下自發進行,則該反應△H>0 | |
| B. | 電鍍時,鍍層金屬跟直流電源的負極相連 | |
| C. | 鍋爐內壁上沉積的CaSO4可先用飽和Na2CO3溶液浸泡,再將不溶物用稀鹽酸溶解除去 | |
| D. | 向100 mL純水中滴加1 mL濃硫酸,水的離子積常數Kw減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
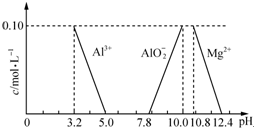 達喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.
達喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
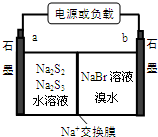 N、O、Na、Mg、S、Br是常見的六種元素.
N、O、Na、Mg、S、Br是常見的六種元素.| 第一電離能 | 粒子半徑 | 熔點 | 鍵的極性 |
| N>S | S2->Mg2+ | SO3<Na2O2 | H-O<H-N |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com