
 達喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.
達喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.分析 (1)1mol達喜中含cmolOH-、dmolCO32-,xmolH2O,與鹽酸反應均生成水;
(2)化合物中遵循電荷守恒,則3a+2b=c+2d;
(3)實驗①加入90mL鹽酸,恰好溶液,產生溶液中溶質為氯化鋁、氯化鎂,實驗②加氨水使Al3+轉化為沉淀,此時Mg2+沒有轉化為沉淀,溶液中溶質為NaCl、MgCl2,由實驗③可知,1.02g為氧化鋁的質量,以此計算.
解答 解:(1)1mol達喜中含cmolOH-、dmolCO32-,xmolH2O,與鹽酸反應均生成水,由原子守恒可知,生成水的物質的量為(x+c+d)mol,故答案為:x+c+d;
(2)化合物中遵循電荷守恒,則3a+2b=c+2d,陽離子帶的電荷大于陰離子帶的電荷,則陽離子的數目小,即a+b<c+d,故答案為:<;
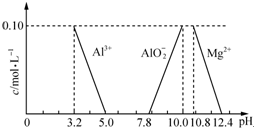
(3)②由圖可知,調節溶液的pH至5.0~7.0,鎂離子沒有轉化為沉淀,只有鋁離子轉化為沉淀,則①所得溶液中加入適量的氨水調節pH,故答案為:氨水;
③鹽酸的總物質的量為2.00mol•L-1×0.09L=0.18mol,
產生CO2消耗鹽酸的物質的量為(0.09-0.085)L×2.00 mol•L-1×2=0.02mol,
CO32-的物質的量為0.02mol÷2=0.01 mol,
由①可知加入鹽酸后先中和掉OH-,然后將CO32轉變成HCO3-,后加入的鹽酸再與HCO3-反應生成CO2,故n(Cl-)=n(OH-)+2n(CO32-),故n(OH-)=0.18mol-0.01mol×2=0.16mol,
n(Al3+)=2n(Al2O3)=2×$\frac{1.02g}{102g/mol}$=0.02mol,
由電荷守恒2n(Mg2+)+3n(Al3+)=n(OH-)+2n(CO32-),故2n(Mg2+)=0.16mol+0.01mol×2-0.02mol×3=0.12mol,故n(Mg2+)=0.06mol,
m(H2O)=6.02g-0.6g-2.72g-1.44g-0.54g=0.72g,故n(H2O)=$\frac{0.72g}{18g/mol}$=0.04 mol,
則n(Al3+):n(Mg2+):n(OH-):n(CO32-):n(H2O)=0.02:0.06:0.16:0.01:0.04=2:6:16:1:4,達喜的組成為Al2Mg6(OH)16CO3•4H2O,
答:達喜的組成為Al2Mg6(OH)16CO3•4H2O.
點評 本題考查化學反應的有關計算,為高頻考點,注意利用守恒進行計算是解答的關鍵,注意理解守恒思想,側重分析與計算能力的考查,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 除去瓷器表面污垢可以選用熱的燒堿溶液 | |
| B. | 溶質質量分數:醫用酒精>食醋>生理鹽水 | |
| C. | 絢麗繽紛的煙花是因添加了鉀、鈉、鈣、銅等金屬元素的焰色反應形成的 | |
| D. | 研制開發燃料電池汽車,降低機動車尾氣污染,某種程度上可以減少PM2.5污染 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
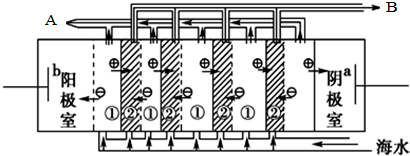 電滲析法淡化海水時陰極室可獲得的重要化工原料有氫氣、氫氧化鈉.
電滲析法淡化海水時陰極室可獲得的重要化工原料有氫氣、氫氧化鈉.| CaSO4 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解精煉銅時,電解液CuSO4溶液的物質的量濃度不變 | |
| B. | NaClO溶液中通入少量CO2后,ClO-水解程度增大,溶液堿性增強 | |
| C. | SO3(g)+H2O(l)═H2SO4(aq)在常溫下能自發進行,則該反應的△H<0 | |
| D. | 0.1 mo1•L-1 CH3COOH溶液加水稀釋后,溶液中$\frac{{c(CH}_{3}C{OO}^{-1})}{{c(CH}_{3}COOH)}$的值減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
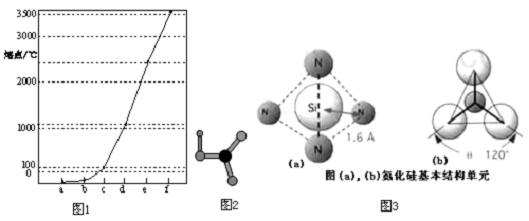
| A. | 原子半徑大小的比較:r(X)>r(Y)>r(Z) | |
| B. | 元素Y、Z的簡單離子的電子層結構不同 | |
| C. | 元素X的簡單氣態氫化物的熱穩定性比元素Y的強 | |
| D. | 只含W、X、Y三種元素的化合物中,有離子化合物,也有共價化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 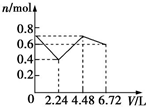 | B. | 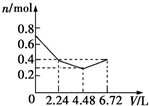 | C. | 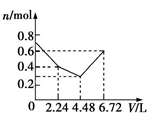 | D. | 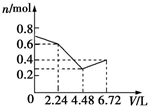 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鎳及其化合物應用廣泛
鎳及其化合物應用廣泛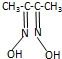 ) 常用于檢驗Ni:在一定條件下,丁二酮肟與Ni2+反應可生成鮮紅色沉淀,其結構如圖1所示.
) 常用于檢驗Ni:在一定條件下,丁二酮肟與Ni2+反應可生成鮮紅色沉淀,其結構如圖1所示.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com