

分析 原子序數由小到大排列的四種短周期元素X、Y、Z、W,四種元素的原子序數之和為32,在周期表中X是原子半徑最小的元素,則X為H元素;Y、Z左右相鄰,Z、W位于同主族,原子序數Y<Z<W,則三者的相對位置為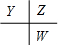 ,設Y的原子序數為a,則Z的原子序數為a+1,W的原子序數為a+9,所以a+a+1+a+9=32-1,解得:a=7,故Y為N元素,Z為O元素,W為S元素,據此結合元素周期律知識進行解答.
,設Y的原子序數為a,則Z的原子序數為a+1,W的原子序數為a+9,所以a+a+1+a+9=32-1,解得:a=7,故Y為N元素,Z為O元素,W為S元素,據此結合元素周期律知識進行解答.
解答 解:原子序數由小到大排列的四種短周期元素X、Y、Z、W,四種元素的原子序數之和為32,在周期表中X是原子半徑最小的元素,則X為H元素;Y、Z左右相鄰,Z、W位于同主族,原子序數Y<Z<W,則三者的相對位置為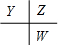 ,設Y的原子序數為a,則Z的原子序數為a+1,W的原子序數為a+9,所以a+a+1+a+9=32-1,解得:a=7,故Y為N元素,Z為O元素,W為S元素,
,設Y的原子序數為a,則Z的原子序數為a+1,W的原子序數為a+9,所以a+a+1+a+9=32-1,解得:a=7,故Y為N元素,Z為O元素,W為S元素,
(1)X和W組成的化合物為硫化氫,H2S為共價化合物,分子中存在兩個H-S鍵,用電子式表示其形成過程為: ,
,
故答案為:
(2)由X與Z組成的化合物,常用于殺菌消毒,該化合物為雙氧水,雙氧水的結構式為:H-O-O-H,
故答案為:H-O-O-H;
(3)由X、Y、Z、W四種元素中的三種組成的一種強酸,該強酸的稀溶液不能與銅反應、濃溶液能與銅反應,該強酸為硫酸,銅與濃硫酸反應的化學方程式為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(4)①由氫、氮、氧、硫組成的離子化合物可能為硫酸銨、硫酸氫銨、亞硫酸銨、亞硫酸氫銨等,1 mol生成氣體2 mol說明一分子這種離子化合物中含有2分子銨根離子,銨根離子與氫氧根離子反應方程式為NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑,
故答案為:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑;
②此種化合物與氯氣反應說明為亞硫酸根離子,故此種化合物為亞硫酸銨,與氯氣反應的離子方程式為②SO32-+Cl2+H2O=SO42-+2Cl-+2H+,
故答案為:SO32-+Cl2+H2O=SO42-+2Cl-+2H+;
(5)B中含有氫、氮、氧、硫、鐵五種元素,取B的溶液加入過量濃NaOH溶液并加熱,產生白色沉淀和無色刺激性氣味氣體.過一段時間白色沉淀變為灰綠色,最終變為紅褐色,說明B中有亞鐵離子和銨根離子,B的溶液,加入過量BaCl2溶液產生白色沉淀,加鹽酸沉淀不溶解,說明有硫酸根離子,1mol B中含有6mol結晶水,說明B帶六個結晶水,由相對分子質量為392可知分子式只能為(NH4)2Fe (SO4)2•6H2O,
故答案為:(NH4)2Fe (SO4)2•6H2O.
點評 本題考查了位置、結構與性質的關系,題目難度中等,利用原子序數關系來判斷元素的種類為解答關鍵,注意掌握原子結構與元素周期律、元素周期表的關系,試題側重考查學生的分析、理解能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
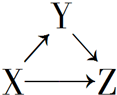 X、Y、Z有如圖所示的轉化關系,則X和Y可能是( )
X、Y、Z有如圖所示的轉化關系,則X和Y可能是( )| A. | ①②③④ | B. | ①② | C. | ③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 除去瓷器表面污垢可以選用熱的燒堿溶液 | |
| B. | 溶質質量分數:醫用酒精>食醋>生理鹽水 | |
| C. | 絢麗繽紛的煙花是因添加了鉀、鈉、鈣、銅等金屬元素的焰色反應形成的 | |
| D. | 研制開發燃料電池汽車,降低機動車尾氣污染,某種程度上可以減少PM2.5污染 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子最外層電子數為2的元素一定處于周期表IIA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,則X與Y 的原子序數之差可能為2或5 | |
| C. | 除零族元素外,短周期元素的最高化合價在數值上都等于該元素所屬的族序數 | |
| D. | 同主族元素形成的氧化物的晶體類型均相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
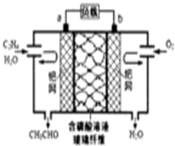
| A. | 每有0.1molO2反應,則遷移H+0.4mol | |
| B. | 該電池為可充電電池 | |
| C. | 電子移動方向:電極a→磷酸溶液→電極b | |
| D. | 正極反應式為:CH2=CH2-2e-+2OH→CH3CHO+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、Ba2+、NO3-、Cl-、 | B. | H+、Fe2+、ClO-、SO42- | ||
| C. | K+、Fe3+、C6H5O-、SCN- | D. | NH4+、Al3+、SiO32-、CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
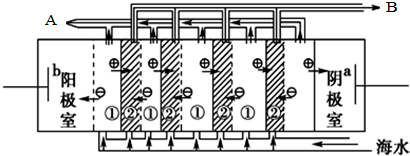 電滲析法淡化海水時陰極室可獲得的重要化工原料有氫氣、氫氧化鈉.
電滲析法淡化海水時陰極室可獲得的重要化工原料有氫氣、氫氧化鈉.| CaSO4 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 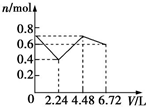 | B. | 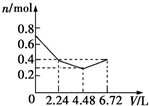 | C. | 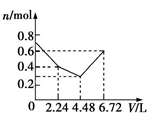 | D. |  |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com