
 氨是一種重要的化工原料,也是重要的工業產品,在工農業生產和國防等領域發揮著重要作用.
氨是一種重要的化工原料,也是重要的工業產品,在工農業生產和國防等領域發揮著重要作用.分析 (1)氨和水類似,也能發生電離:NH3+NH3=NH4++NH2-,將2.3g金屬鈉投入1.0L液氨中會結合NH2-,促進液氨的電離,鈉與液氨反應生成NaNH2,結合化學方程式計算;
(2)用Pt電極對液氨進行電解可產生H2和N2,陰極上氨氣或銨根離子得電子生成氫氣;
(3)氨氣催化還原NO生成沒有污染的物質為氮氣和水;
(4)測得N2為0.10mol,H2為0.30mol,NH3為0.10mol,根據方程式知,參加反應的氫氣物質的量=0.15mol,則H2的平衡轉化率=$\frac{參加反應的氫氣物質的量}{氫氣初始物質的量}$×100%;平衡是c(N2)=0.10mol/L、c(H2)=0.30mol/L、c(NH3)=0.10mol/L,在該溫度下的平衡常數K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}).{c}^{3}({H}_{2})}$;
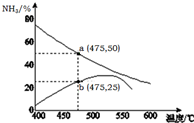
(5)根據圖知,a是平衡曲線、b是經過一定時間反應后的曲線,該溫度下要使該反應達到平衡狀態,應該增大氨氣含量,平衡正向移動.
解答 解:(1)將2.3g金屬鈉投入1.0L液氨中發生反應為:2Na+2NH3=2NaNH2+H2↑;促進液氨的電離,依據:NH3+NH3=NH4++NH2-,[NH4+][NH2-]=l.0×l0-30;反應生成NH2-物質的量為0.1mol,濃度為0.1mol/L,所得溶液中NH4+的濃度l.0×l0-29mol/L,
故答案為:1.0×l0-29mol/L;
(2)用Pt電極對液氨進行電解可產生H2和N2,陰極上氨氣或銨根離子得電子生成氫氣,電極反應式為2NH3+2e-=H2+2NH2- 或 2NH4++2e-=H2+2NH3,
故答案為:2NH3+2e-=H2+2NH2- 或 2NH4++2e-=H2+2NH3;
(3)氨氣催化還原NO生成沒有污染的物質為氮氣和水,反應方程式為4NH3+6NO$\frac{\underline{\;催化劑\;}}{\;}$5N2+6H2O,
故答案為:4NH3+6NO$\frac{\underline{\;催化劑\;}}{\;}$5N2+6H2O;
(4)測得N2為0.10mol,H2為0.30mol,NH3為0.10mol,根據方程式知,參加反應的氫氣物質的量=0.15mol,則H2的平衡轉化率=$\frac{參加反應的氫氣物質的量}{氫氣初始物質的量}$×100%=$\frac{0.15mol}{0.3mol+0.15mol}$×100%=33.3%;平衡是c(N2)=0.10mol/L、c(H2)=0.30mol/L、c(NH3)=0.10mol/L,在該溫度下的平衡常數K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}).{c}^{3}({H}_{2})}$=$\frac{0.1{0}^{2}}{0.10×0.3{0}^{3}}$=3.70,
故答案為:33.3%;3.70;
(5)根據圖知,a是平衡曲線、b是經過一定時間反應后的曲線,該溫度下要使該反應達到平衡狀態,應該增大氨氣含量,平衡正向移動,則正反應速率大于逆反應速率,故答案為:>.
點評 本題考查化學平衡有關計算及電解原理,為高頻考點,側重考查學生分析計算能力,明確化學平衡計算方法、電解原理是解本題關鍵,難點是(5)題,會根據物質濃度相對大小確定反應方向,題目難度中等.


 A加金題 系列答案
A加金題 系列答案 全優測試卷系列答案
全優測試卷系列答案科目:高中化學 來源: 題型:解答題
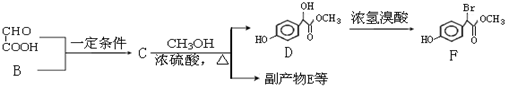
 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖是在航天用高壓氫鎳電池基礎上發展起來的一種金屬氫化物鎳電池(MH-Ni電池).下列有關說法不正確的是( )
如圖是在航天用高壓氫鎳電池基礎上發展起來的一種金屬氫化物鎳電池(MH-Ni電池).下列有關說法不正確的是( )| A. | 放電時正極反應為:NiOOH+H2O+e-=Ni(OH)2+OH- | |
| B. | 電池的電解液可為KOH溶液 | |
| C. | 充電時負極反應為:MH+OH-=M+H2O+e- | |
| D. | MH是一類儲氫材料,其氫密度越大,電池的能量密度越高 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
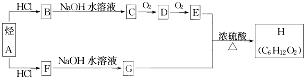
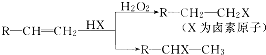
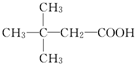 .(用結構簡式表示)
.(用結構簡式表示)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯氣溶于水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 硫酸氫鈉溶液與氫氧化鋇溶液混合至混合液呈中性:2HSO4-+Ba2++2OH-=BaSO4↓+2H2O+SO42- | |
| C. | 向雙氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O | |
| D. | 用銅作陽極電解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;電解\;}}{\;}$2Cu+O2↑+4H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 從海水中提取鎂 | B. | 用酒精測試儀檢測酒駕 | ||
| C. | 將氯氣通入冷的消石灰中制漂白粉 | D. | 石油分餾 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 22% | B. | 70% | C. | 66.7% | D. | 33.3% |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com