
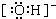
分析 (1)根據價層電子對互斥理論確定離子空間構型及原子雜化方式;
(2)根據元素符號,判斷元素原子的核外電子數,再根據構造原理來寫;氫氧根離子中氫原子與氧原子間共用1對電子;
(3)同周期自左而右元素第一電離能呈增大趨勢,但N元素原子的2p能級含有3個電子,處于半滿穩定狀態,能量較低,失去第1個電子需要的能量較大;
(4)根據等電子體是指具有相同電子數目和原子數目的分子或離子來回答;
(5)碳原子的成鍵情況主要根據與碳原子形成共價鍵的原子的數目確定.
解答 解:(1)NH3的中心原子N的價層電子對個數=3+$\frac{1}{2}$×(5+-3×1)=4,價層電子對數為4,而且含有1個孤電子對,所以其空間構型三角錐形;
故答案為:三角錐;
(2)Fe元素為26號元素,原子核外有26個電子,所以核外電子排布式為:1s22s22p63s23p63d64s2,Fe失去三個電子得到Fe3+,Fe3+的電子排布式為1s22s22p63s23p63d5;所以基態Fe3+的價電子排布式為3d5;氫氧根離子中氫原子與氧原子間共用1對電子,其電子式為 ;
;
故答案為:3d5; ;
;
(3)同周期自左而右第一電離能呈增大趨勢,N元素原子的2p能級有3個電子,為半滿穩定狀態,能量降低,失去第一個電子需要的能量較高,第一電離能高于同周期相鄰元素,故第一電離能N>O>C,
故答案為:N>O>C;
(4)CNO-中電子數為:6+7+8+1=22,與CO2具有相同電子數目和原子數目,是等電子體,常見粒子還有CO2(或N2O、CS2等)等;
故答案為:CO2(或N2O、CS2等);
(5)HCN分子中有1個碳原子和1個氮原子,1個氫原子,碳是中心原子,采用sp2雜化,碳與氫形成單鍵,與氮形成三鍵,則結構式為H-C≡N,
故答案為:H-C≡N.
點評 本題考查了價層電子對互斥理論的應用、電子排布式、電子式、第一電離能、等電子體、結構式等,題目涉及的知識點較多,側重于考查學生對基礎知識的綜合應用能力,題目難度中等.


 課堂全解字詞句段篇章系列答案
課堂全解字詞句段篇章系列答案 步步高口算題卡系列答案
步步高口算題卡系列答案 點睛新教材全能解讀系列答案
點睛新教材全能解讀系列答案 小學教材完全解讀系列答案
小學教材完全解讀系列答案科目:高中化學 來源: 題型:選擇題
| A. | 石油、天然氣等燃燒產生大量二氧化碳 | |
| B. | 大量燃燒含硫量高的煤產生二氧化硫 | |
| C. | 森林遭到亂砍爛伐,破壞了生態環境 | |
| D. | 各種機動車排放的尾氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 在外電路中,電子由銀電極流向銅電極 | |
| B. | 取出鹽橋后,電流計的指針仍發生偏轉 | |
| C. | 外電路中每通過0.1 mol電子,銅的質量理論上減小6.4 g | |
| D. | 原電池的總反應式為Cu+2AgNO3=2Ag+Cu(NO3)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
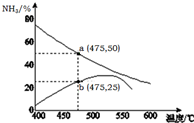 氨是一種重要的化工原料,也是重要的工業產品,在工農業生產和國防等領域發揮著重要作用.
氨是一種重要的化工原料,也是重要的工業產品,在工農業生產和國防等領域發揮著重要作用.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 既能與酸又能與堿反應的物質一定是兩性氧化物或兩性氫氧化物 | |
| B. | 往Fe(OH)3膠體中逐滴加入稀H2SO4溶液時,開始時會出現沉淀,再繼續滴加時,沉淀又會消失 | |
| C. | 膠體區別于其他分散系的本質特征是丁達爾現象 | |
| D. | 某物質溶于水后所得溶液能導電,該物質一定屬于電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向0.1mol•L-1氨水中加入少量水,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$減少 | |
| B. | 將NH4Cl溶液從20℃升溫至30℃,溶液中$\frac{c(N{H}_{4})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$增大 | |
| C. | 向氫氧化鈉溶液中加入醋酸至中性,溶液中$\frac{c(C{H}_{3}COO)}{c(N{a}^{+})}$=1 | |
| D. | 向含有BaSO4、BaCO3的飽和溶液中加入少量的Ba(NO3)2,溶液中的$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗編號 | HA物質的量濃度(mol•L-1) | NaOH物質的量濃度(mol•L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
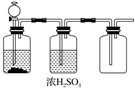
| A. | FeS和稀H2SO4 | B. | 加熱NaCl和濃H2SO4制HCl | ||
| C. | 大理石和稀鹽酸 | D. | MnO2和濃鹽酸 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com