
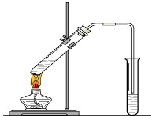
 “酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如圖所示的裝置制取乙酸乙酯.回答下列問題:
“酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如圖所示的裝置制取乙酸乙酯.回答下列問題:分析 (1)乙醇、乙酸易溶于水,導管在液面下可發生倒吸;
(2)酯化反應為可逆反應,且濃硫酸具有吸水性;
(3)飽和碳酸鈉溶液可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度;
(4)酯化反應為可逆反應;
(5)乙酸與乙醇發生酯化反應生成乙酸乙酯和水.
解答 解:(1)乙醇、乙酸易溶于水,導管在液面下可發生倒吸,則導氣管不能插入Na2CO3溶液中是為了防止倒吸,
故答案為:防止倒吸;
(2)酯化反應為可逆反應,且濃硫酸具有吸水性,則濃H2SO4的作用是催化劑、吸水劑,
故答案為:催化劑;吸水劑;
(3)飽和Na2CO3溶液的作用是吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,偏于分層,然后分液可分離,
故答案為:吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度;
(4)反應中乙醇和乙酸的轉化率不能達到100%,原因是酯化反應為可逆反應,反應物不能完全轉化為生成物,
故答案為:酯化反應為可逆反應;
(5)乙酸與乙醇發生酯化反應生成乙酸乙酯和水,反應為CH3COOH+C2H5OH$?_{△}^{濃H_{2}SO_{4}}$CH3COOC2H5+H2O,
故答案為:CH3COOH+C2H5OH$?_{△}^{濃H_{2}SO_{4}}$CH3COOC2H5+H2O.
點評 本題考查有機物的制備實驗,為高頻考點,把握有機物的結構與性質、有機反應為解答的關鍵,側重分析與實驗能力的考查,注意混合物分離的應用,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 1 000 mL容量瓶,58.5 g NaCl | B. | 980 mL容量瓶,57.3 g NaCl | ||
| C. | 500 mL容量瓶,58.5 gNaCl | D. | 1 000 mL容量瓶,117.0 g NaC1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 乙酸是食醋的主要成分,它具有以下化學性質:
乙酸是食醋的主要成分,它具有以下化學性質:查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| |溫度/℃ | 700 | 800 | 900 | 1000 | 1200 |
| 平衡常數 | 0.5 | 0.6 | 1.0 | 1.6 | 2.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 如圖是某學校實驗室從化學試劑商店買回的濃硫酸試劑標簽上的部分內容.
如圖是某學校實驗室從化學試劑商店買回的濃硫酸試劑標簽上的部分內容.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.08 | B. | 0.04 | C. | 0.032 | D. | 0.036 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com