
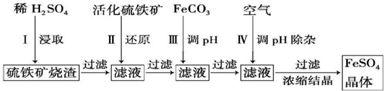
分析 硫鐵礦燒渣用硫酸浸取,過濾后濾液中含有硫酸鐵、未反應的硫酸,用活化硫鐵礦還原Fe3+后過濾,向濾液中加入FeCO3調節溶液pH,過濾后在通入空氣、調節溶液pH,除去溶液中雜質離子,過濾濃縮結晶得到FeSO4晶體.
(1)H2SO4與Fe2O3反應生成硫酸鐵與水;
(2)用KSCN 溶液檢驗第Ⅱ步中Fe3+是否完全還原;
(3)氧氣可以講亞鐵離子氧化為鐵離子,鐵離子水解使溶液pH降低;
(4)電池放電時的總反應為:4Li+FeS2═Fe+2Li2S,正極發生還原反應,FeS2獲得電子生成Fe、S2-;
(5)發生反應:4FeCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+4CO2,根據蓋斯定律,由已知熱化學方程式乘以適當的系數進行加減,構造目標熱化學方程式;
(6)第Ⅲ步應加入FeCO3后,浸取時加入的硫酸、活化硫鐵礦還原Fe3+時生成的硫酸完全轉化為FeSO4,根據FeS2~7Fe2(S04)3~7Fe2O3計算參加反應的FeS2的物質的量,根據硫元素守恒計算n總(FeSO4),由Fe元素守恒計算n(FeCO3),再根據m=nM計算其質量.
解答 解:硫鐵礦燒渣用硫酸浸取,過濾后濾液中含有硫酸鐵、未反應的硫酸,用活化硫鐵礦還原Fe3+后過濾,向濾液中加入FeCO3調節溶液pH,過濾后在通入空氣、調節溶液pH,除去溶液中雜質離子,過濾濃縮結晶得到FeSO4晶體.
(1)H2SO4與Fe2O3反應生成硫酸鐵與水,反應離子方程式為:Fe2O3+6H+=2Fe3++3H2O,
故答案為:Fe2O3+6H+=2Fe3++3H2O;
(2)KMnO4溶液可以檢驗有Fe2+生成,取第Ⅱ步反應中溶液少許與試管中,滴加KSCN 溶液,若溶液不變紅色,說明Fe3+完全被還原,也可以加入淀粉-碘化鉀溶液,鐵離子存在會氧化碘離子生成碘單質,溶液變藍色,故選BC,
故答案為:BC;
(3)氧氣可以將Fe2+離子氧化為Fe3+離子,Fe3+離子水解生成H+,使溶液pH降低,
故答案為:氧氣可以將Fe2+離子氧化為Fe3+離子,Fe3+離子水解生成H+;
(4)電池放電時的總反應為:4Li+FeS2═Fe+2Li2S,正極發生還原反應,FeS2獲得電子生成Fe、S2-,正極電極反應式為:FeS2+4e-=Fe+2S2-,
故答案為:FeS2+4e-=Fe+2S2-;
(5)發生反應:4FeCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+4CO2,
已知:①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
②C(s)+O2(g)═CO2(g)△H=-392kJ/mol
③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
根據蓋斯定律,①-③×2+②×④可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),故△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-392kJ/mol)=-256kJ/mol,
故反應熱化學方程式為:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-256kJ/mol,
故答案為:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-256kJ/mol;
(6)假如燒渣中的鐵全部視為Fe2O3,其含量為p.將b kg質量分數為c的硫酸加入到a kg燒渣中浸取,鐵的浸取率為q,
Fe2O3含量為P,akg燒渣中,Fe2O3質量為P×akg,鐵的浸取率為q,側參加反應的Fe2O3質量為P×akg×q,其物質的量=$\frac{(P×a×1{0}^{3}×q)g}{160g/mol}$,bkg質量分數為c的硫酸中m(H2SO4)=c×bkg,其物質的量=$\frac{bc×1{0}^{3}g}{98g/mol}$mol,
第Ⅲ步應加入FeCO3后,浸取時加入的硫酸、活化硫鐵礦還原Fe3+時生成的硫酸完全轉化為FeSO4,
根據FeS2~7Fe2(S04)3~7Fe2O3,可知參加反應的FeS2的物質的量$\frac{1}{7}$×$\frac{(P×a×1{0}^{3}×q)g}{160g/mol}$,
根據硫元素守恒計算n總(FeSO4)=$\frac{1}{7}$×$\frac{(P×a×1{0}^{3}×q)g}{160g/mol}$×2+$\frac{bc×1{0}^{3}g}{98g/mol}$,
由Fe元素守恒n(FeCO3)=n總(FeSO4)-n(FeS2)-2n(Fe2O3)=$\frac{1}{7}$×$\frac{(P×a×1{0}^{3}×q)g}{160g/mol}$×2+$\frac{bc×1{0}^{3}g}{98g/mol}$-$\frac{1}{7}$×$\frac{(P×a×1{0}^{3}×q)g}{160g/mol}$-2×$\frac{(P×a×1{0}^{3}×q)g}{160g/mol}$=$\frac{bc×1{0}^{3}g}{98g/mol}$-$\frac{13}{7}$×$\frac{(P×a×1{0}^{3}×q)g}{160g/mol}$,故m(FeCO3)=[$\frac{bc×1{0}^{3}g}{98g/mol}$-$\frac{13}{7}$×$\frac{(P×a×1{0}^{3}×q)g}{160g/mol}$]×116g/mol≈(1.18bc-1.35pqa)×103g=(1.18bc-1.35pqa)kg,
故答案為:1.18bc-1.35pqa.
點評 本題以化學工藝流程為載體,考查離子方程式書寫、離子檢驗、熱化學方程式書寫、電極反應式、化學計算等,需要學生熟練掌握元素化合物知識,(6)中計算為易錯點、難點,注意利用守恒法計算,避免計算繁瑣,較好的考查學生分析計算能力.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 30.5 | B. | 26.3 | C. | 26 | D. | 24 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 氫氧化物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 開始沉淀時 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀時 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
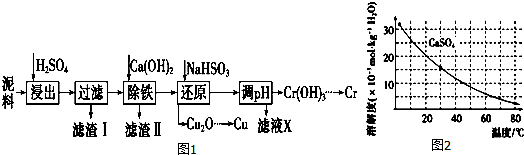
| Fe3+ | Cu2+ | Cr3+ | |
| 開始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
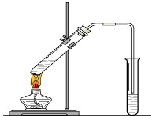 “酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如圖所示的裝置制取乙酸乙酯.回答下列問題:
“酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如圖所示的裝置制取乙酸乙酯.回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com