
分析 (1)根據c=$\frac{1000ρω}{M}$計算出質量分數為65%、密度為1.4g/cm3的濃硝酸的濃度,然后根據溶液稀釋前后溶質的物質的量不變計算出配制3mol/L的硝酸100mL,需要該濃硝酸的體積;
(2)4NH3+5O2$\frac{\underline{催化劑}}{△}$4NO+6H2O①與4NO+3O2+2H2O→4HNO3②相加得到4NH3+8O2=4HNO3+4H2O,據此計算硝酸的質量分數;
(3)質量轉化為物質的量,依據NH3~HNO3,計算硝酸的物質的量,依據V=$\frac{m}{V}$計算硝酸溶液的密度,依據公式C=$\frac{n}{V}$計算硝酸的物質的量濃度;
(4)①設混合氣體中含有xmolNO,ymolNO2,依據題干條件n(NO):n(NO2)=9:1,及總質量為3160mg,計算兩種氣體的物質的量,
氫氧化鈉與一氧化氮氣體、二氧化氮混合氣體反應,方程式為:NO+NO2+2NaOH=2NaNO2+H2O,反應后剩余氣體為一氧化氮,將剩余其一般氧化為二氧化氮,依據得失電子守恒計算氧化一氧化氮用的氧氣的體積,依據富氧空氣中氧氣的含量計算需要富氧空氣的體積;
②依據得失電子守恒可知NO、NO2中氮原子變為氮氣中0價的N 得到電子總數等于NH3中-3價的N變為氮氣中0價的N失去電子總數,據此解答.
解答 解:(1)質量分數為65%、密度為1.4g/cm3的濃硝酸的濃度為:c=$\frac{1000×1.4×65%}{63}$mol/L=14.4mol/L,
溶液稀釋前后溶質的物質的量不變,則:C濃•V濃=C稀•V稀
14.4mol/L•V濃=3mol/L•0.1L
解得:V濃=0.0208L=20.8ml,
故答案為:14.44 mol/L; 20.8 ml;
(2)4NH3+5O2$\frac{\underline{催化劑}}{△}$4NO+6H2O①與4NO+3O2+2H2O→4HNO3②相加得到4NH3+8O2=4HNO3+4H2O,所以硝酸的質量分數為:$\frac{4×63}{4×63+4×18}$×100%=0.78;
故答案為:78%;
(3)1.70噸液氨的物質的量為:$\frac{1.7×1{0}^{6}}{17}$=0.1×106mol,依據轉化關系4NH3+8O2=4HNO3+4H2O,可知生成的硝酸的物質的量為0.1×106mol;消耗氧氣的物質的量為:0.2×106mol;依據方程式4NH3+8O2=4HNO3+4H2O,可知硝酸溶液的質量=液氨的質量+水的質量+消耗氧氣的質量=1.70×106+4.50×106+×32×0.2×106=12.6×106(g)
該硝酸溶液的體積V=$\frac{m}{ρ}$=$\frac{12.6×1{0}^{6}}{1.31×1{0}^{3}}$=9.62×103(L),則C(HNO3)=$\frac{n}{V}$=$\frac{0.1×1{0}^{6}}{9.62×1{0}^{3}}$=10.40(mol/L);
故答案為:10.40;
(4)①由題意可知:n(NO):n(NO2)=9:1,及總質量為3160mg,設設混合氣體中含有xmolNO,ymolNO2,
則:x:y=9:1;30x+46y=3.16;解得x=0.09;y=0.01;
與一氧化氮氣體、二氧化氮混合氣體反應,方程式為:NO+NO2+2NaOH=2NaNO2+H2O,
1 1
0.01mol 0.01mol
剩余NO物質的量為0.09mol-0.01mol=0.08mol,要想完全被吸收,則只需要用氧氣氧化0.04molNO生成0.04mol二氧化氮,依據得失電子守恒得:0.04mol
×(4-2)=n(O2)×4,解得n(O2)=0.02mol,標況下體積為:0.02mol×22.4L/mol=0.448L,
而富氧空氣中O2的體積分數為0.25,所以需要富氧空氣的體積為:0.448L÷0,25=1.792L;
答:至少需要補充標準狀況下的富氧空氣1.792L;
②由①知1m3硝酸工業的尾氣中含3160mg NOx,含有NO0.09mol,含有NO20.01mol,如果用氨催化還原法,即用氨作催化劑,將NO、NO2轉化為氮氣直接排入空氣中,設需要氨氣的物質的量為:n(NH3)則依據得失電子守恒可知:0.09mol×(2-0)+0.01mol×(4-0)=n(NH3)×(0-(-3)),
解得n(NH3)=$\frac{0.22}{3}$(mol)
其質量為:$\frac{0.22}{3}$mol×17g/mol=1.25g;
答:氨氣的質量為1.25g.
點評 本題考查了有關方程式的計算,明確方程式中各物質的物質的量的關系及物質的性質是解題關鍵,注意原子個數、得失電子數守恒規律的應用,題目難度較大.


 能力評價系列答案
能力評價系列答案科目:高中化學 來源: 題型:解答題
| 化學式 | 電離常數(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
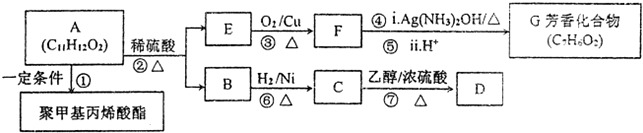
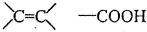 ;檢驗其宮能團所用化學試劑有溴的四氯化碳(或酸性高錳酸鉀溶液)、碳酸氫鈉溶液(或石蕊試劑).
;檢驗其宮能團所用化學試劑有溴的四氯化碳(或酸性高錳酸鉀溶液)、碳酸氫鈉溶液(或石蕊試劑). .
. (CH3)2CHCOOCH2CH3+H2O.
(CH3)2CHCOOCH2CH3+H2O.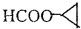 .
.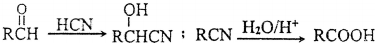
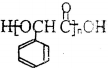 ,方框內寫中間體的結構簡式,在“→”上方或下方寫反應所需條件或試劑.
,方框內寫中間體的結構簡式,在“→”上方或下方寫反應所需條件或試劑.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
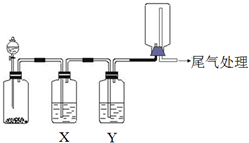 利用如圖裝置可以進行實驗并能達到實驗目的是( )
利用如圖裝置可以進行實驗并能達到實驗目的是( )| 選項 | 實驗目的 | X中試劑 | Y中試劑 |
| A | 用MnO2和濃鹽酸制取并收集純凈干燥的Cl2 | 飽和食鹽水 | 濃硫酸 |
| B | 用Cu與稀硝酸制取并收集純凈干燥的NO | 水 | 濃硫酸 |
| C | 驗證電石與飽和食鹽水反應生成的氣體的性質并收集 | CuSO4溶液 | KMnO4 溶液 |
| D | CaCO3和稀鹽酸制取并收集純凈干燥的CO2 | 飽和NaHCO3溶液 | 濃硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
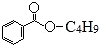 ,下列說法錯誤的是( )
,下列說法錯誤的是( )| A. | X難溶于水 | B. | X的分子式為C11H14O2 | ||
| C. | 組成為-C4H9的烴基有3種 | D. | X能發生加成反應、取代反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫酸、純堿、漂白粉 | B. | 硫酸、燒堿、小蘇打 | ||
| C. | 硫酸氫鈉、生石灰、醋酸鈉 | D. | 磷酸、熟石灰、苛性鈉 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
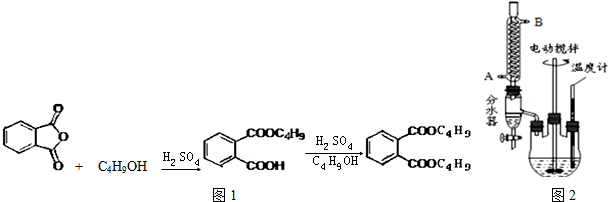
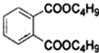 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com