
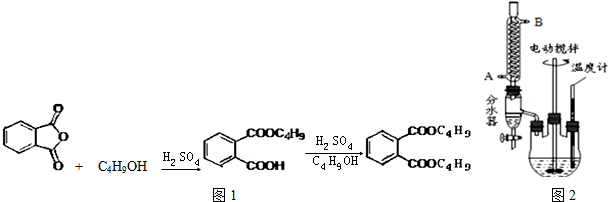
 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.分析 (1)水是生成物,不斷的分離生成物,使平衡向著正向移動,可以提高反應物的轉化率;反應結束時,分水器中的水位高度不變,冷凝管中不再有液體滴下;
(2)正丁醇可能發生消去反應,也可以發生分子間脫水反應生成醚等;
(3)若使用氫氧化鈉溶液,會發生鄰苯二甲酸二丁酯在堿性條件下的水解反應生成 與正丁醇;
與正丁醇;
(4)操作X是將互不相溶的液體進行分離,應采取分液操作;
(5)鄰苯二甲酸二丁酯的沸點340℃,溫度超過180℃時易發生分解,應減壓蒸餾使其沸點降低,防止分解;
(6)由于正丁醇不足,假設鄰正丁醇完全轉化,以此計算鄰苯二甲酸二丁酯的理論產量,產率=(實際產量÷理論產量)×100%.
解答 解:(1)水是生成物,不斷的分離生成物,使平衡向著正向移動,可以提高反應物的轉化率;分水器中的水位高度基本保持不變時(或者冷凝管中不再有液體滴下),說明反應結束,
故答案為:有利于反應向生成鄰苯二甲酸二丁酯的方向移動,提高產率;分水器中的水位高度基本保持不變時(或者冷凝管中不再有液體滴下);
(2)正丁醇可能發生消去反應,也可以發生分子間脫水反應生成醚等,實驗中副產物的結構簡式為:CH2=CHCH2CH3 、CH3CH2CH2CH2OCH2CH2CH2CH3等,
故答案為:CH2=CHCH2CH3、CH3CH2CH2CH2OCH2CH2CH2CH3等;
(3)若使用氫氧化鈉溶液,會發生鄰苯二甲酸二丁酯在堿性條件下的水解反應生成 與正丁醇,反應方程式為:
與正丁醇,反應方程式為: +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2CH3CH2CH2CH2OH,
+2CH3CH2CH2CH2OH,
故答案為: +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2CH3CH2CH2CH2OH;
+2CH3CH2CH2CH2OH;
(4)操作X是將互不相溶的液體進行分離,應采取分液操作,操作中必須使用的主要玻璃儀器有:分液漏斗、燒杯,
故答案為:分液漏斗、燒杯;
(5)鄰苯二甲酸二丁酯沸點較高,高溫蒸餾會造成其分解,減壓可使其沸點降低,防止分解,
故答案為:鄰苯二甲酸二丁酯沸點較高,高溫蒸餾會造成其分解,減壓可使其沸點降低;
(6)由于正丁醇不足,假設正丁醇完全轉化,則鄰苯二甲酸二丁酯的理論產量為:$\frac{0.3mol}{2}$×278g/mol=41.7g,故其產率為$\frac{20.85g}{41.7g}$×100%=50%,
故答案為:50%.
點評 本題考查制備方案的設計,題目難度中等,涉及物質的分離提純、對操作及原理的分析評價、產率計算等知識,掌握實驗操作的要求和實驗原理是解題的關鍵,試題培養了學生的分析能力及化學實驗能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
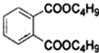
 小明同學設計了如圖所示裝置探究銅跟濃硫酸的反應.先關閉活塞a,加熱至燒瓶中不再有氣泡產生時,反應停止,此時燒瓶中銅片仍有剩余.接著再打開活塞a,將氣球中的氧氣緩緩擠入燒瓶,銅片慢慢減少.
小明同學設計了如圖所示裝置探究銅跟濃硫酸的反應.先關閉活塞a,加熱至燒瓶中不再有氣泡產生時,反應停止,此時燒瓶中銅片仍有剩余.接著再打開活塞a,將氣球中的氧氣緩緩擠入燒瓶,銅片慢慢減少.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
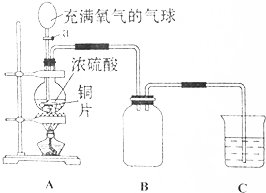
| A. | 360 kJ/mol | B. | 263 kJ/mol | C. | 1 173 kJ/mol | D. | 391 kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 將等物質的量濃度的CuSO4溶液和NaCl溶液等體積混合后,用石墨電極進行電解,電解中溶液pH隨時間t變化的曲線如圖,則下列說法正確的是( )
將等物質的量濃度的CuSO4溶液和NaCl溶液等體積混合后,用石墨電極進行電解,電解中溶液pH隨時間t變化的曲線如圖,則下列說法正確的是( )| A. | 陽極產物一定是Cl2,陰極產物一定是Cu | |
| B. | BC段表示在陰極上是H+放電產生了H2 | |
| C. | CD段表示電解水 | |
| D. | CD段表示陽極上OH-放電破壞了水的電離平衡,產生了H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 完全燃燒生成二氧化碳和水的化合物不一定是烴 | |
| B. | 相同質量的正丁烷和異丁烷分別完全燃燒,耗氧量相等 | |
| C. | 相同物質的量乙烯和乙醇分別完全燃燒,耗氧量相等 | |
| D. | 相同質量的乙烷和乙炔分別完全燃燒,耗氧量相等 |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年浙江省高一上10月月考化學試卷(解析版) 題型:實驗題

(1)該硫酸的物質的量濃度是________mol/L。
(2)某化學興趣小組進行硫酸性質的實驗探究時,需要490 mL 4.6 mol/L的稀硫酸,則需要取________mL的該硫酸。
(3)配制時,所需的玻璃儀器除量筒、燒杯、玻璃棒和膠頭滴管之外,還需要 (填儀器名稱);
(4)配制溶液有如下(未按順序排列):a.溶解,b.搖勻,c.洗滌,d.冷卻,e.稱量,f.將溶液移至容量瓶,g.定容等操作。 其中搖勻的前一步操作是 ;(填寫字母)
(5)在下列配制過程示意圖中,有錯誤的是(填寫序號) 。

(6)在配制4.6 mol/L的稀硫酸的過程中,下列情況會引起硫酸溶液物質的量濃度偏高的是_________
A.未經冷卻趁熱將溶液注入容量瓶中 | B.容量瓶洗滌后,未經干燥處理 |
C.定容時仰視觀察液面 | D.未洗滌燒杯和玻璃棒 |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年天津市高一上9月調研化學試卷(解析版) 題型:填空題
(易混易錯題組)有關物質的量濃度的計算
(1)將4gNaOH固體溶于水配成250mL溶液,此溶液中NaOH的物質的量濃度為_________mol/L。取出10mL此溶液,其中含有NaOH_________g。將取出的溶液加水稀釋到100mL,稀釋后溶液中NaOH的物質的量濃度為_________mol/L。

(2)如圖實驗室某濃鹽酸試劑瓶標簽上的有關數據,據此計算:該濃鹽酸中HCl的物質的量濃度為__________mol/L;用上述濃鹽酸和蒸餾水配制500 mL物質的量濃度為0.400 mol/L的稀鹽酸。需要量取___________mL上述濃鹽酸進行配制。
(3)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42-的物質的量濃度為__________mol/L
(4)標準狀況下,將V L A氣體(摩爾質量為M g/mol)溶于0.1L水(密度1 g/cm3)中,所得溶液的密度為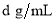 ,則此溶液的物質的量濃度為 mol/L
,則此溶液的物質的量濃度為 mol/L
A. B.
B. C.
C. D.
D.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com