
 氫氣是新型能源和重要化工原料.
氫氣是新型能源和重要化工原料.| 容器編號 | 起始時各物質的物質的量/mol | 平衡時反應中的能量變化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3n | n | 0 | 放出熱量a kJ |
| Ⅱ | 3n | 2n | 0 | 放出熱量b kJ |
| Ⅲ | 6n | 2n | 0 | 放出熱量c kJ |
| 時間/min | 0 | 5 | 10 | 15 | 20 | 25 | … |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 |
分析 (1)②-①-③×2得:CH4(g)+CO2(g)=2CO(g)+2H2(g),根據蓋斯定律計算反應的焓變;根據化學反應可知,甲烷將二氧化碳轉化成有價值的合成氣;
(2)①A、實驗I和III比較,實驗III相當于實驗I體積壓縮一半,加壓時平衡向正方向移動,I、II實驗中氫氣量相等,氮氣量越多,氮氣轉化率減小,據此回答;
B、根據可逆反應特點,3mol氫氣和1mol氮氣不能完全生成NH3;
C、根據壓強對化學平衡移動的影響來回答;
D、溫度不變,平衡常數不變.
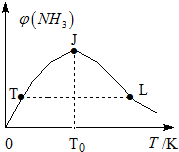
②TJ段未達到平衡,反應向生成氨方向進行,溫度升高,反應加快,氨氣體積分數增大;當J點達到平衡,JL段:該正反應是放熱反應,升高溫度,平衡向逆方向移動,促進氨分解,氨的體積分數減小.L點溫度高于T點溫度,兩點的各物質濃度相等;
③根據v=$\frac{△c}{△t}$計算氫氣表示的反應速率,根據化學反應中速率之比等于系數之比,v(NH3);
④稀溶液總體積等于兩種溶液體積之和,根據電荷守恒計算離子的濃度,根據電離平衡常數表達式計算即可;
(3)氫氣直接作燃料電池的負極上的反應是:H2-2e-+2OH-=2H2O,根據能量密度定義計算即可.
解答 解:(1)根據蓋斯定律知,②-①-③×2得:CH4(g)+CO2(g)=2CO(g)+2H2(g),所以CH4(g)+CO2(g)=2CO(g)+2H2(g)△H,△H=△H2-△H1-2△H3,這種方法的推廣與使用,不僅實現資源綜合利用,根據化學反應可知,甲烷將二氧化碳轉化成有價值的合成氣,還能解決環境問題是減少二氧化碳排放.故答案為:△H2-△H1-2△H3;根據化學反應可知,甲烷將二氧化碳轉化成有價值的合成氣,減少二氧化碳排放;
(2)①A、實驗I和III比較,實驗III相當于實驗I體積壓縮一半,加壓時平衡向正方向移動,N2轉化率增大,III中氮氣轉化率大于I中氮氣轉化率;I、II實驗中氫氣量相等,氮氣量越多,氮氣轉化率減小,I中氮氣轉化率大于II中氮氣轉化率,故III、I、II中氮氣轉化率依次增大,A錯誤;
B、可逆反應的熱化學方程式表示:1mol氮氣和3mol氫氣完全反應放出92.4kJ熱量.根據可逆反應特點,3mol氫氣和1mol氮氣不能完全生成NH3.II生成的氨氣量大于I,B項正確;
C、如果平衡不移動,III中氨氣量是I中2倍,氨氣體積分數相等.在恒容條件下,I容器加壓變成III,增大壓強,平衡向生成NH3方向移動,氨體積分數增大,C正確;
D、溫度不變,平衡常數不變,三個容器中平衡常數相等,D錯誤.
故選BC;
②TJ段未達到平衡,反應向生成氨方向進行,溫度升高,反應加快,氨氣體積分數增大;當J點達到平衡,JL段:該正反應是放熱反應,升高溫度,平衡向逆方向移動,促進氨分解,氨的體積分數減小.L點溫度高于T點溫度,兩點的各物質濃度相等,所以,L點氨的正反應速率較大.
故答案為:小于;
③在該條件下,前5分鐘氨氣平均反應速率為$\frac{\frac{2.0mol-1.0mol}{2L}}{5min}$=0.1mol/(L•min),根據化學反應中速率之比等于系數之比,得出v(H2)=1.5v(NH3)=
=0.15mol/(L•min),故答案為:0.15mol/(L•min);
④稀溶液總體積等于兩種溶液體積之和.根據電荷守恒式c(NH4+)+c(H+)=c(OH-)+2c(SO42-),當溶液呈中性時c(H+)=c(OH-),推知:c(NH4+)=2c(SO42-),c(SO42-)=0.5a mol/L,c(NH4+)=a mol/L,c(H+)=c(OH-)=1.0×10-7mol/L,c(NH3•H2O)+c(NH4+)=0.5b mol/L,c(NH3•H2O)=(0.5b-a)mol/L.Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-7}a}{0.5b-a}$=$\frac{2a}{(b-2a)×107}$,故答案為:$\frac{2a}{(b-2a)×107}$;
(3)H2-2e-+2OH-=2H2O,根據能量密度定義,E=$\frac{\frac{1.2V×\frac{1000g}{2g/mol×2×96500C/mol}}{1kg}}{3.6×1{0}^{6}J•k{W}^{-1}•{h}^{-1}}$=32.2kW•h•kg-1.
故答案為:$\frac{\frac{1.2V×\frac{1000g}{2g/mol×2×96500C/mol}}{1kg}}{3.6×1{0}^{6}J•k{W}^{-1}•{h}^{-1}}$=32.2kW•h•kg-1.
點評 本題綜合考查學生化學反應速率的計算、化學平衡移動原理的應用、溶液中離子濃度之間的關系等知識,注意知識的歸納和梳理是解題的關鍵,難度大.


科目:高中化學 來源: 題型:解答題
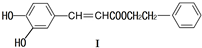 在藥物、涂料等領域應用廣泛.
在藥物、涂料等領域應用廣泛.
 ;反應類型:水解(取代)反應
;反應類型:水解(取代)反應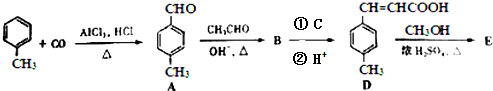
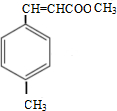 .
.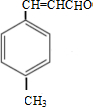 $\stackrel{一定條件}{→}$
$\stackrel{一定條件}{→}$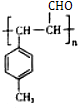 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
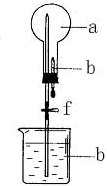 在如圖所示的裝置中,燒瓶中充滿干燥氣體a,將滴管中的液體b擠入燒瓶內,輕輕振蕩燒瓶,然后打開彈簧夾f,燒杯中的液體b呈噴泉狀噴出,最終幾乎充滿燒瓶.則a和b不滿足題目要求的是( )
在如圖所示的裝置中,燒瓶中充滿干燥氣體a,將滴管中的液體b擠入燒瓶內,輕輕振蕩燒瓶,然后打開彈簧夾f,燒杯中的液體b呈噴泉狀噴出,最終幾乎充滿燒瓶.則a和b不滿足題目要求的是( )| a(干燥氣體) | b(液體) | |
| A | NO2 | 水 |
| B | CO2 | 4mol/LNaOH溶液 |
| C | Cl2 | 飽和NaOH溶液 |
| D | NH3 | 1mol/L鹽酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②④ | B. | ①③⑥ | C. | ④⑤⑥ | D. | ①⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 18.8g苯酚中含有碳碳雙鍵的個數為0.6NA | |
| B. | 17g羥基(-OH)所含有的電子數是10NA | |
| C. | 標準狀況下,11.2L 三氯甲烷所含分子數為0.5NA | |
| D. | 常溫常壓下,3.0g葡萄糖和冰醋酸的混合物中含有的原子總數為0.4NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入氬氣,V正、V逆都增大,且V正增大倍數大于V逆增大倍數 | |
| B. | 加入催化劑,V正、V逆都發生變化,且變化的倍數相同 | |
| C. | 增大壓強時,V正、V逆都增大,且V正增大倍數大于V逆增大倍數 | |
| D. | 降低溫度時,V正、V逆都減小,且V正減小倍數小于V逆減小倍數 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| B. | 棉、麻、絲、毛及合成纖維完全燃燒都只生成CO2和H2O | |
| C. | 植物油和裂化汽油可用溴水鑒別 | |
| D. | 在雞蛋白溶液中加入濃HNO3,微熱后會生成黃色物質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某元素基態原子的電子排布圖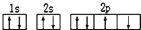 | |
| B. | NH4Cl電子式為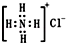 | |
| C. | Ca2+離子基態電子排布式為1s22s22p63s23p6 | |
| D. | 鉀(K)的原子結構示意圖為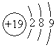 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com