
分析 (1)碳酸根和鹽酸反應產生二氧化碳氣體,鋇離子、鋁離子、三價鐵離子和碳酸根不共存,碳酸氫銨溶液和鹽酸反應產生二氧化碳氣體,HCO3-和AlO2-反應產生氫氧化鋁沉淀,Ba(OH)2溶液和碳酸氫銨溶液反應產生氨氣和碳酸鋇白色沉淀;
(2)實驗①中偏鋁酸根離子和酸反應生成鋁離子,碳酸根離子和氫離子反應生成二氧化碳和水;
(3)過量鹽酸中加入過量碳酸氫銨溶液,碳酸氫銨溶液和鹽酸反應產生二氧化碳氣體;碳酸氫銨溶液中的HCO3-和AlO2-之間能反應產生氫氧化鋁沉淀;
(4)②所得溶液中有剩余的碳酸氫銨,Ba(OH)2溶液能和碳酸氫銨溶液反應產生氨氣和碳酸鋇白色沉淀,硫酸根是否存在不確定,可能有BaSO4.
解答 解:(1)所有離子中只有碳酸根和鹽酸反應產生氣體二氧化碳,所以一定含有碳酸根離子,而鋇離子、鋁離子、三價鐵離子和碳酸根不共存,所以一定沒有鋇離子、鋁離子、三價鐵離子,溶液中必須有陽離子,所以一定含有鈉離子,過量鹽酸中加入過量碳酸氫銨溶液,碳酸氫銨溶液和鹽酸反應產生二氧化碳氣體,碳酸氫銨溶液中的HCO3-和AlO2-之間能反應產生氫氧化鋁沉淀,所以一定含有AlO2-,②所得溶液中有剩余的碳酸氫銨,Ba(OH)2溶液能和碳酸氫銨溶液反應產生氨氣和碳酸鋇白色沉淀,所以硫酸根是否存在不確定,
故答案為:Ba2+、Al3+、Fe3+;SO42-;
(2)①加入過量鹽酸,有氣體生成,只有碳酸根和鹽酸反應產生氣體二氧化碳,CO32-+2H+=H2O+CO2↑,根據以上分析還有H+和AlO2-之間反應,AlO2-+4H+=Al3++2H2O,
故答案為:AlO2-+4H+=Al3++2H2O;CO32-+2H+=H2O+CO2↑;
(3)②在上面所得的溶液中再加入過量碳酸氫銨溶液,過量鹽酸中加入過量碳酸氫銨溶液,碳酸氫銨溶液和鹽酸反應產生二氧化碳氣體,碳酸氫銨溶液中的HCO3-和AlO2-之間反應產生氫氧化鋁沉淀,
故答案為:CO2;Al(OH)3;
(4)銨根離子和氫氧根離子反應生成氨氣,堿性溶液中碳酸氫根離子和堿反應生成碳酸根離子,碳酸根離子和鋇離子反應生成碳酸鋇沉淀,硫酸根是否存在不確定,可能有BaSO4,
故答案為:NH3;BaCO3或BaCO3與BaSO4的混合物.
點評 本題考查了常見離子的檢驗方法,題目難度中等,注意根據溶液呈電中性判斷溶液中存在的離子方法,本題充分考查了學生的分析、理解能力,要求熟練掌握常見離子的檢驗方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 熱穩定性:H2O>HF>H2S | |
| B. | NH4Cl的電子式: | |
| C. | 反應NH3(g)+HCl(g)=NH4Cl(s)在室溫下可自發進行,則該反應的△H<0 | |
| D. | 合成氨生產過程中將NH3液化分離,可加快正反應速率,提高N2、H2的轉化率 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
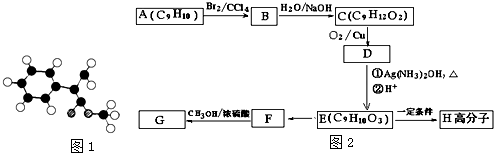
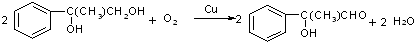 ;
;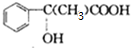 $\stackrel{一定條件下}{→}$
$\stackrel{一定條件下}{→}$ +(n-1)H2O.
+(n-1)H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
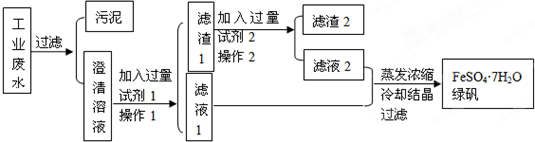
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5:8:12 | B. | 15:14:21 | C. | 10:14:21 | D. | 30:28:23 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com