
| A. | 熱穩定性:H2O>HF>H2S | |
| B. | NH4Cl的電子式: | |
| C. | 反應NH3(g)+HCl(g)=NH4Cl(s)在室溫下可自發進行,則該反應的△H<0 | |
| D. | 合成氨生產過程中將NH3液化分離,可加快正反應速率,提高N2、H2的轉化率 |
分析 A、元素的非金屬性越強,對應的氫化物越穩定;
B、電子式需要把各微粒中最外層電子標出,氯離子最外層電子數未標出;
C、依據反應能否自發進行的判據解答,:△H-T△S<0反應自發進行;
D、減少生成物的濃度,反應速率減小.
解答 解:A、非金屬性F>O>S,元素的非金屬性越強,對應的氫化物越穩定,所以穩定性:HF>H2O>H2S,故A錯誤;
B、氯化銨是離子化合物,由氨根離子與氯離子構成,電子式為: ,故B錯誤;
,故B錯誤;
C、反應能自發進行說明:△H-T△S<0,由方程式NH3(g)+HCl(g)═NH4Cl(s)可知該反應的<0,要使:△H-T△S<0,所以必須滿足△H<0,故C正確;
D、減少生成物的濃度,反應速率減小,則合成氨生產過程中將NH3液化分離,減小正反應速率,平衡正移,提高N2、H2的轉化率,故D錯誤;
故選C.
點評 本題考查了氫化物穩定性分析,電子式書寫判斷,反應自發進行的判斷依據,反應速率影響元素等知識點,掌握基礎是關鍵,題目較簡單.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
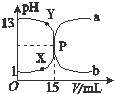 如圖曲線a和b是鹽酸與氧氧化鈉溶液在常溫下的相互滴定的滴定曲線,下列敘述中正確的是( )
如圖曲線a和b是鹽酸與氧氧化鈉溶液在常溫下的相互滴定的滴定曲線,下列敘述中正確的是( )| A. | 鹽酸的物質的量濃度為1 mol•L-1 | |
| B. | P點時反應恰好完成,溶液呈中性,但它不是滴定終點 | |
| C. | X點時c(Cl-)>c(H+)>c(Na+)>c(OH-) | |
| D. | Y點時溶液呈堿性,溶液中c(H+)•c(OH-)>1×10-14 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;A與C組成的化合物電子式為
;A與C組成的化合物電子式為 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子學說 | B. | 分子學說 | C. | 等電子體學說 | D. | 元素周期律 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com