
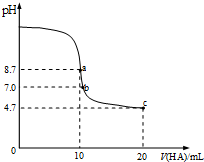
 室溫下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的變化曲線如圖所示.下列說法正確的是( )
室溫下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的變化曲線如圖所示.下列說法正確的是( )| A. | a點溶液中:c(Na+)>c(A-)>c(H+)>c(HA) | B. | a、c兩點溶液中水的電離程度相同 | ||
| C. | b點溶液中:c(Na+)=c(A-)+c(HA) | D. | c點溶液中:c(A-)>c(HA) |
分析 室溫下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,a點酸堿的物質的量相等,二者恰好反應生成NaA,但溶液呈堿性,說明生成的鹽是強堿弱酸鹽,則HA是弱酸;
要使混合溶液呈中性,則HA應該稍微過量,所以b點HA體積大于10mL,c點溶液中溶質為等物質的量濃度的NaA、HA,溶液呈酸性,說明HA電離程度大于A-水解程度;
A.a點時酸堿恰好中和,溶液pH=8.7,說明HA為弱酸,NaA溶液水解呈堿性;
B.c點時HA過量,溶液呈酸性,HA電離出H+,抑制水的電離;
C.pH=7時,c(H+)=c(OH-),結合電荷守恒判斷;
D.c點HA過量一倍,溶液存在NaA和HA,溶液呈酸性,說明HA電離程度大于A-水解程度
解答 解:室溫下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,a點酸堿的物質的量相等,二者恰好反應生成NaA,但溶液呈堿性,說明生成的鹽是強堿弱酸鹽,則HA是弱酸;
要使混合溶液呈中性,則HA應該稍微過量,所以b點HA體積大于10mL,c點溶液中溶質為等物質的量濃度的NaA、HA,溶液呈酸性,說明HA電離程度大于A-水解程度;
A.a點時酸堿恰好中和,溶液pH=8.7,說明HA為弱酸,NaA溶液水解呈堿性,應為c(HA)>c(H+),故A錯誤;
B.a點A-水解,促進水的電離,c點時HA過量,溶液呈酸性,HA電離出H+,抑制水的電離,故B錯誤;
C.pH=7時,c(H+)=c(OH-),由電荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),則c(Na+)=c(A-),故C錯誤;
D.c點HA過量一倍,溶液存在NaA和HA,溶液呈酸性,說明HA電離程度大于A-水解程度,則存在c(A-)>c(HA),故D正確;
故選D.
點評 本題以酸堿混合溶液定性判斷為載體考查離子濃度大小比較,為高頻考點,明確各點溶液中溶質及其性質是解本題關鍵,易錯選項是C,注意任何電解質溶液中都存在電荷守恒,與溶液酸堿性無關.


科目:高中化學 來源: 題型:多選題
| A. | SO2既是氧化產物又是還原產物 | |
| B. | CuFeS2僅作還原劑,硫元素被氧化 | |
| C. | 每生成1 mol Cu2S,同時生成22.4L SO2 | |
| D. | 有0.2 mol硫被氧化時,轉移1.2NA個電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
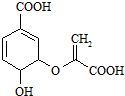
| A. | 分子式為C10H8O6 | |
| B. | 分子中含有2種官能團 | |
| C. | 可與乙醇、乙酸反應,且反應類型相同 | |
| D. | 1mol分枝酸最多可與3mol NaOH發生中和反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

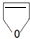 或
或 .
.


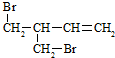
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
 ;Ca的最外層電子數為2.
;Ca的最外層電子數為2.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿性鋅錳電池是二次電池 | |
| B. | 鉛蓄電池是二次電池 | |
| C. | 二次電池又叫蓄電池,它放電后可以再充電使活性物質獲得再生 | |
| D. | 燃料電池的活性物質沒有儲存在電池內部 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com