
 ,B與亞硝酸,在0~5℃反應后生成的產物與溴亞化銅和氰化鉀反應生成C,C與氫氧化鈉溶液共熱生成2-氯-4-硝基苯酚,試推測A、B、C的構造式.
,B與亞硝酸,在0~5℃反應后生成的產物與溴亞化銅和氰化鉀反應生成C,C與氫氧化鈉溶液共熱生成2-氯-4-硝基苯酚,試推測A、B、C的構造式. 分析 有機物中硝基可以被還原為氨基,含有氨基和羧基的物質間可以發生反應,得肽鍵,肽鍵水解得到羧基和氨基,鹵代烴在堿性條件下發生水解反應可以得到含有羥基的物質,根據物質的性質結合反應產物來回答.
解答 解:合物A含有C、H、O、N、Cl,A與酸的水溶液加熱下反應,可得化合物B和醋酸,肽鍵水解得到羧基和氨基,所以A中含有肽鍵,B經還原可生成 ,有機物中硝基可以被還原為氨基,所以B中含有一個硝基,即B為
,有機物中硝基可以被還原為氨基,所以B中含有一個硝基,即B為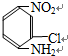 ,所以A是B和醋酸之間發生反應得到的產物,A中含有肽鍵,即A為:
,所以A是B和醋酸之間發生反應得到的產物,A中含有肽鍵,即A為: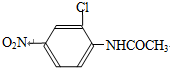 ,其中的硝基不能是氨基,其中的氨基也不能是硝基,與亞硝酸,在0~5℃反應后生成的產物與溴亞化銅和氰化鉀反應生成C,C與氫氧化鈉溶液共熱生成2-氯-4-硝基苯酚,鹵代烴在堿性條件下發生水解反應可以得到含有羥基的物質,所以產物中的-OH來自原來的-Br,即C的結構簡式為:
,其中的硝基不能是氨基,其中的氨基也不能是硝基,與亞硝酸,在0~5℃反應后生成的產物與溴亞化銅和氰化鉀反應生成C,C與氫氧化鈉溶液共熱生成2-氯-4-硝基苯酚,鹵代烴在堿性條件下發生水解反應可以得到含有羥基的物質,所以產物中的-OH來自原來的-Br,即C的結構簡式為: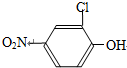 ,
,
答:A為 ;B為
;B為 ;C為
;C為 .
.
點評 本題考查學生有機物的結構和性質以及有機物的推斷知識,注意知識的遷移應用是解題的關鍵,難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 溶液出現藍色且30s內不褪色
溶液出現藍色且30s內不褪色
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

| 溫度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯水的顏色呈淺黃綠色,說明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,產生白色沉淀,說明氯水中含有Cl- | |
| C. | 向淀粉碘化鉀溶液中滴加少量氯水,溶液變藍,說明氯水中含有ClO- | |
| D. | 向氯水中加入NaHCO3粉末,有氣泡產生,說明氯水中含有H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某探究小組為探究氯氣的性質,并用裝置F制取少量“漂白液”,設計了如下實驗裝置.請回答下列問題:
某探究小組為探究氯氣的性質,并用裝置F制取少量“漂白液”,設計了如下實驗裝置.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 光照新制的氯水時,溶液的pH逐漸減小 | |
| B. | 高溫高壓有利于N2和H2轉化為NH3:N2(g)+3H2(g)?2NH3(g);△H<0) | |
| C. | 打開汽水瓶時,有大量氣泡逸出 | |
| D. | 氨水應密閉保存于低溫處 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com