

| 溫度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
分析 (1)根據實驗裝置和操作步驟可知,實驗室制備無水FeCl3,是利用鐵與鹽酸反應生成FeCl2,然后把FeCl2氧化成FeCl3,先制得FeCl3•6H2O晶體,再脫結晶水制得無水FeCl3.燒杯中足量的H2O2溶液是作氧化劑,把亞鐵離子全部氧化成三價鐵離子;
(2)鐵與鹽酸反應完全時,不再產生氫氣,所以裝置A中不產生氣泡或量氣管和水準管的液面不再變化,此時,可將A中FeCl2溶液放入燒杯中進行氧化.
(3)從FeCl3溶液制得FeCl3•6H2O晶體的操作步驟是:蒸發濃縮、冷卻結晶、過濾、洗滌、干燥.
(4)從工業制備流程圖分析可知,反應爐中進行的反應是 2Fe+3Cl2=2FeCl3,因此,進入吸收塔中的尾氣是沒有參加反應的氯氣,在吸收塔中氯氣被吸收劑吸收,反應后生成2FeCl3溶液,所以吸收劑應是2FeCl2溶液,反應的離子方程式為:2Fe2++Cl2=2Fe3++2Cl-.
(5)捕集器收集的是氣態FeCl3,FeCl3的相對分子質量是162.5,由相對分子質量為325的鐵的氯化物可以推出,當溫度超過673K時,二分子氣態FeCl3可以聚合生成雙聚體Fe2Cl6;
(6)①稱取m g無水氯化鐵樣品,溶于稀鹽酸,配制成100mL溶液;取出10.00mL,加入稍過量的KI溶液,充分反應后,滴入幾滴淀粉溶液,此時溶液呈藍色,用 Na2S2O3溶液滴定,滴入最后一滴Na2S2O3溶液,錐形瓶內的溶液由藍色變為無色,且半分鐘內不變色.所以滴定終點的現象是:溶液由藍色變為無色,且半分鐘內不變色.
②根據化學方程式求樣品中氯化鐵的質量分數.
解答 解:(1)根據實驗裝置和操作步驟可知,實驗室制備無水FeCl3,是利用鐵與鹽酸反應生成FeCl2,然后把FeCl2氧化成FeCl3,先制得FeCl3•6H2O晶體,再脫結晶水制得無水FeCl3.燒杯中足量的H2O2溶液是作氧化劑,把亞鐵離子全部氧化成三價鐵離子;
故答案為:把亞鐵離子全部氧化成三價鐵離子;
(2)鐵與鹽酸反應完全時,不再產生氫氣,所以裝置A中不產生氣泡或量氣管和水準管的液面不再變化,此時,可將A中FeCl2溶液放入燒杯中進行氧化;
故答案為:裝置A中不產生氣泡或量氣管和水準管液面不變(其他合理答案也給分);
(3)從FeCl3溶液制得FeCl3•6H2O晶體的操作步驟是:蒸發濃縮、冷卻結晶、過濾、洗滌、干燥;
故答案為:鹽酸;蒸發濃縮、冷卻結晶;
(4)從工業制備流程圖分析可知,反應爐中進行的反應是 2Fe+3Cl2=2FeCl3,因此,進入吸收塔中的尾氣是沒有參加反應的氯氣,在吸收塔中氯氣被吸收劑吸收,反應后生成2FeCl3溶液,所以吸收劑應是2FeCl2溶液,反應的離子方程式為:2Fe2++Cl2=2Fe3++2Cl-,
故答案為:2Fe2++Cl2=2Fe3++2Cl-;
(5)捕集器收集的是氣態FeCl3,FeCl3的相對分子質量是162.5,由相對分子質量為325的鐵的氯化物可以推出,當溫度超過673K時,二分子氣態FeCl3可以聚合生成雙聚體Fe2Cl6,
故答案為:Fe2Cl6;
(6)①稱取m g無水氯化鐵樣品,溶于稀鹽酸,配制成100mL溶液;取出10.00mL,加入稍過量的KI溶液,充分反應后,滴入幾滴淀粉溶液,此時溶液呈藍色,用 Na2S2O3溶液滴定,滴入最后一滴Na2S2O3溶液,錐形瓶內的溶液由藍色變為無色,且半分鐘內不變色.所以滴定終點的現象是:溶液由藍色變為無色,且半分鐘內不變色,
故答案為:溶液由藍色變無色,且半分鐘內不變色;
②由反應:2Fe3++2I -=2Fe2++I2; I2+2S2O32-═2I-+S4O62-;可得關系式:
2Fe3+-I2-2S2O32-
1 1
n cV×10-3
求得n(Fe3+)=cV×10-3mol,則樣品中氯化鐵的質量分數為:
ω(Fe3+)=cV×10-3mol×10×162.5g/mol×100%=$\frac{162.5cV}{m}$%,
故答案為:$\frac{162.5cV}{m}$%.
點評 本題考查學生對工藝流程的理解、物質的分離提純等基本操作、氧化還原反應滴定應用、溶度積有關計算等,難度中等,需要學生具有扎實的基礎知識與靈活運用知識解決問題的能力.


科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4L鹽酸含有NA個HCl分子 | |
| B. | 1.0 L 1.0 mol•L-1 的NaAl02水溶液中含有的氧原子數為2 NA? | |
| C. | 常溫常壓下,14g由N2與CO組成的混合氣體含有的原子數目為NA | |
| D. | 已知C2H4和C3H6混合物的質量為ag,所含原子總數為$\frac{a{N}_{A}}{14}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
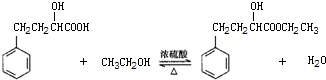
| 相對分子量 | 密度(g/cm3) | 沸點(℃) | 水溶性 | |
| 2-羥基-4-苯基丁酸 | 180 | 1.219 | 357 | 微溶 |
| 乙 醇 | 46 | 0.789 | 78.4 | 易溶 |
| 2-羥基-4-苯基丁酸乙酯 | 208 | 1.075 | 212 | 難溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,B與亞硝酸,在0~5℃反應后生成的產物與溴亞化銅和氰化鉀反應生成C,C與氫氧化鈉溶液共熱生成2-氯-4-硝基苯酚,試推測A、B、C的構造式.
,B與亞硝酸,在0~5℃反應后生成的產物與溴亞化銅和氰化鉀反應生成C,C與氫氧化鈉溶液共熱生成2-氯-4-硝基苯酚,試推測A、B、C的構造式.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A、B、C、D、E、F、G、H八種短周期元素,其單質的沸點如圖所示.
A、B、C、D、E、F、G、H八種短周期元素,其單質的沸點如圖所示.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com