
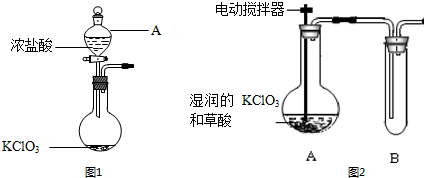

分析 (1)由儀器結構特征,可知A為分液漏斗;氯酸鉀與濃鹽酸反應生成氯氣、氯化鉀與水;
(2)①反應控制溫度為60℃,應采取水浴加熱;
②ClO2是一種黃綠色、有刺激性氣味的氣體,熔點:-59.0℃,沸點:11.0℃,B裝置要放置在冰水中,冷凝便于收集;
③ClO2易與堿反應;
(3)ClO2與H2O2在氫氧化鈉溶液中反應制得NaClO2,Cl元素化合價降低,則ClO2為氧化劑,H2O2為還原劑,過氧化氫中氧元素被氧化;
(4)可以測定相同濃度酸的pH或測定相同濃度亞氯酸鈉和次氯酸鈉溶液的pH.
解答 解:(1)由儀器結構特征,可知A為分液漏斗;氯酸鉀與濃鹽酸反應生成氯氣、氯化鉀與水,反應方程式為:KClO3+6HCl(濃)═3Cl2↑+KCl+3H2O,
故答案為:分液漏斗;KClO3+6HCl(濃)═3Cl2↑+KCl+3H2O;
(2)①反應控制溫度為60℃,應采取水浴加熱,故答案為:水浴加熱;
②ClO2是一種黃綠色、有刺激性氣味的氣體,熔點:-59.0℃,沸點:11.0℃,B裝置要放置在冰水中,使ClO2 冷凝,便于收集,故答案為:使ClO2 冷凝,便于收集;
③ClO2易與堿反應,可以用氫氧化鈉溶液吸收,故選:B;
(3)ClO2與H2O2在氫氧化鈉溶液中反應制得NaClO2,Cl元素化合價降低,則ClO2為氧化劑,H2O2為還原劑,過氧化氫中氧元素被氧化,氧化產物為,故答案為:O2;
(4)分別取等物質的量濃度的亞氯酸和次氯酸溶液于兩個燒杯中,測其pH值,次氯酸溶液的pH比亞氯酸溶液的pH大,
故答案為:分別取等物質的量濃度的亞氯酸和次氯酸溶液于兩個燒杯中,測其pH值;次氯酸溶液的pH比亞氯酸溶液的pH大.
點評 本題考查物質制備實驗、對操作與裝置的分析評價、氧化還原反應、實驗方案設計等,是對基礎知識的綜合應用,注意對題目信息的應用,難度中等.


 能力評價系列答案
能力評價系列答案 唐印文化課時測評系列答案
唐印文化課時測評系列答案科目:高中化學 來源: 題型:選擇題
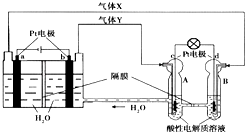 空間實驗室“天宮一號”的供電系統中有再生氫氧燃料電池(RFC),RFC是一種將水電解技術與氫氧燃料電池技術相結合的可充電電池.如圖為RFC工作原理示意圖,有關說法正確的是( )
空間實驗室“天宮一號”的供電系統中有再生氫氧燃料電池(RFC),RFC是一種將水電解技術與氫氧燃料電池技術相結合的可充電電池.如圖為RFC工作原理示意圖,有關說法正確的是( )| A. | 當有0.1mol電子轉移時,a極產生1.12L O2(標況) | |
| B. | b極上發生的電極反應是:2H++2e-═H2↑ | |
| C. | d極上發生的電極反應是:O2+4H++4e-═2H2O | |
| D. | c極上進行還原反應,B中的H+可以通過隔膜進入A |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
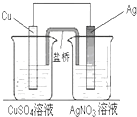 用銅片、銀片、CuSO4溶液、AgNO3溶液、導線和鹽橋(裝有瓊脂-KNO3的U形管)構成一個原電池(如圖).以下有關該原電池的敘述正確的是 ( )
用銅片、銀片、CuSO4溶液、AgNO3溶液、導線和鹽橋(裝有瓊脂-KNO3的U形管)構成一個原電池(如圖).以下有關該原電池的敘述正確的是 ( )| A. | ①② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在蔗糖中加入濃硫酸后出現發黑現象,說明濃硫酸具有脫水性 | |
| B. | 濃硝酸在光照下顏色變黃,說明濃硝酸不穩定 | |
| C. | 常溫下,濃硝酸可以用鋁罐貯存,說明鋁與濃硝酸不反應 | |
| D. | 向碘水中滴加CCl4,振蕩靜置后分層,CCl4層呈紫紅色,說明可用CCl4從碘水中萃取碘 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熱穩定性NaHCO3<Na2CO3 | B. | 常溫時水中溶解度NaHCO3>Na2CO3: | ||
| C. | 與鹽酸反應的速率:NaHCO3>Na2CO3 | D. | 相對分子質量:NaHCO3<Na2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
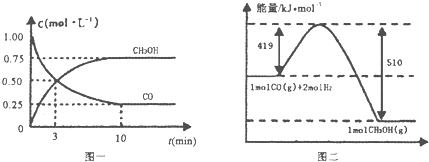
| 容器 | 反應物投入的量 | 反應物的轉化率 | CH3OH的濃度 | 能量變化 (Q1,Q2,Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | a1 | c1 | 放出Q1kJ熱量 |
| 乙 | 1mol CH3OH | a2 | c2 | 吸收Q2kJ熱量 |
| 丙 | 2mol CO和4mol H2 | a3 | c3 | 放出Q3kJ熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
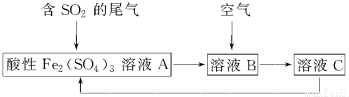
| A. | 溶液B中發生的反應為2SO2+O2═2SO3 | |
| B. | 可用酸性高錳酸鉀溶液檢驗溶液C中是否含有Fe3+ | |
| C. | 由以上流程可推知氧化性:Fe3+>O2>SO42- | |
| D. | 此工藝的優點之一是物質能循環利用 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
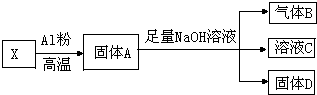 某同學設計實驗將Fe3O4和CuO組成的混合物X進行如圖所示的轉化(每一步均反應完全)
某同學設計實驗將Fe3O4和CuO組成的混合物X進行如圖所示的轉化(每一步均反應完全)查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com