
 NH3•H2ONH3•H2O
NH3•H2ONH3•H2O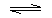 NH4++OH-
NH4++OH-
分析 (1)①氫氧化鈣與氯化銨加熱條件下生成氨氣、氯化鈣和水;制備氨氣的簡易方法:加熱濃氨水,將濃氨水逐滴加入堿石灰(生石灰),結合裝置圖解答;
②氨氣溶液水與水反應生成一水合氨,一水合氨電離生成氨根離子和氫氧根離子,溶液顯堿性,遇到紅色石蕊試紙變藍;
③氨氣與氧氣在鉑做催化劑條件下發生催化氧化生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮與水反應生成硝酸,硝酸與氨氣反應生成硝酸銨,據此解答;
(2)實驗室里檢驗某白色固體是銨鹽,可以將固體溶于水,然后加入氫氧化鈉溶液放熱,再利用濃鹽酸檢驗是否有氨氣生成;
(3)根據反應判斷3Cl2+2NH3→N2+6HCl判斷氨氣過量,計算出生成的氯化氫的體積,再根據氯化氫與氨氣生成氯化銨,計算出二者恰好反應,最后剩余的氣體是氮氣.
解答 解:(1)①加熱消石灰與氯化銨固體反應生成氯化鈣、氨氣和水,方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
圖甲中:A.氯化銨受熱分解生成的氨氣與氯化氫,在試管口又重新反應生成氯化銨,不能制取氨氣,故A選;
B.濃氨水具有揮發性,滴入到生石灰,水與氧化鈣反應放出的熱量促使氨氣揮發,可以制備氨氣,故B不選;
C.試管口應向下傾斜,裝置錯誤,故C選;
D.濃氨水易揮發,加熱濃氨水,促進氨氣逸出,能制取氨氣,故D不選;
故選:AC;
②氨氣可使濕潤的紅色的石蕊試紙變藍的原因,氨氣氨氣溶液水與水反應生成一水合氨,化學方程式:NH3+H2O 
故答案為:NH3+H2O 
③氨氣與氧氣在鉑做催化劑條件下發生催化氧化生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮與水反應生成硝酸,硝酸與氨氣反應生成硝酸銨,該過程中沒有涉及到的物質為氫氣,
故選:A;
(2)實驗室里檢驗某白色固體是銨鹽,可以將固體溶于水,然后加入氫氧化鈉溶液放熱,再利用濃鹽酸檢驗是否有氨氣生成,若產生大量白煙則含有氨氣,用到的藥品有:蒸餾水、氫氧化鈉、濃鹽酸,用不到的是稀硫酸;
故選:D;
(3)15ml Cl2和40ml NH3反應,根據反應方程式3Cl2+2NH3=N2+6HCl,15mL氯氣反應消耗氨氣10mL氨氣,生成5mL氮氣和30mL氯化氫;由于氨氣與氯化氫反應生成氯化銨,剩余的氨氣恰好與生成的氯化銨反應,剩余最后剩余的氣體是氮氣,體積為5mL,
故答案為:5.
點評 本題考查了氨氣的制備和性質的檢驗,熟練掌握氨氣制備原理和裝置特點及氨氣的化學性質是解題關鍵,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | v=0.10 mol•L-1•s-1是指1 s內某物質的物質的量濃度為0.10 mol•L-1 | |
| B. | 對于任何化學反應來說,反應速率越快,反應現象就越明顯 | |
| C. | 化學反應速率只是對可逆反應才適用 | |
| D. | 根據反應速率的大小,可以知道反應進行的相對快慢 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質子數:c>d | B. | 離子的還原性:Y2->Z- | ||
| C. | 氫化物的穩定性:H2Y>HZ | D. | 原子半徑:X<W |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 周期 族 | I | II | III | IV | V | VI | VII | O |
| 二 | C | F | ||||||
| 三 | Na | Mg | Al | Si | S | Cl | Ar |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙醇的結構簡式C2H6O | B. | 溴乙烷的分子式C2H5Br | ||
| C. | 羥基的電子式:${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H | D. | 化學名詞:苯、油酯、坩鍋 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$
 ,④的反應類型取代反應(或水解反應).
,④的反應類型取代反應(或水解反應). .
.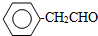 或
或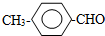 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
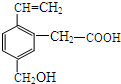 某有機物的結構如圖所示,這種有機物可能具有的性質是( )
某有機物的結構如圖所示,這種有機物可能具有的性質是( )| A. | 只有②④ | B. | 只有②③④ | C. | 只有①②③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
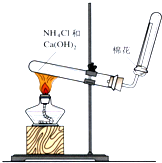 (1)配制0.5mol/L的NaOH溶液,定容時向容量瓶中加蒸餾水超過刻度線,其結果偏小.(填“偏大”、“偏小”、或“不變”)
(1)配制0.5mol/L的NaOH溶液,定容時向容量瓶中加蒸餾水超過刻度線,其結果偏小.(填“偏大”、“偏小”、或“不變”)查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com