
| A. | 在標況下,22.4L SO3和22.4L C2H4原子個數比為2:3 | |
| B. | 將78g Na2O2與過量CO2反應,CO2轉移的電子數為2NA | |
| C. | 含0.2mol H2SO4的濃硫酸與足量銅充分反應,生成SO2分子的數目少于0.1NA | |
| D. | 電解精煉銅時,若陽極質量減少32g,則陰極轉移的電子的數目為NA |
分析 A.標況下三氧化硫不是氣體;
B.過氧化鈉與二氧化碳反應,過氧化鈉既做氧化劑又做還原劑,消耗1mol過氧化鈉轉移1mol電子;
C.只有濃硫酸與銅反應,稀硫酸與銅不反應;
D.粗銅中含有雜質鐵、鋅等較活潑金屬,電解過程中鐵、鋅優先放電.
解答 解:A.氣體摩爾體積適用對象為氣體,標況下三氧化硫不是氣體,不能使用氣體摩爾體積,故A錯誤;
B.78g Na2O2的物質的量為1mol,與過量CO2反應,CO2轉移的電子數為NA,故B錯誤;
C.隨著反應進行,濃硫酸濃度降低,變為稀硫酸不再發生反應,所以含0.2mol H2SO4的濃硫酸與足量銅充分反應,消耗的硫酸小于0.2mol,生成的二氧化硫的數目小于0.1NA,故C正確;
D.電解精煉銅時,若陽極質量減少32g,由于陽極有鐵雜質存在,鐵的摩爾質量小于銅的,所以陽極減少32g,轉移的電子的物質的量大于1mol,則陰極得到的電子數大于NA,故D錯誤;
故選:C.
點評 本題考查了阿伏伽德羅常數的有關計算,熟練掌握公式的運用以及物質的狀態和結構是解題關鍵,注意只有濃硫酸與銅才能發生反應,題目難度不大.


科目:高中化學 來源: 題型:解答題
 如表列出了部分元素在周期表中的位置,請用具體的元素完成下列填空.
如表列出了部分元素在周期表中的位置,請用具體的元素完成下列填空.| 族 周期 | ⅠA | 0 | ||||||||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||||||||
| 2 | X | Y | G | |||||||||||
| 3 | Z | … | H | W | E | |||||||||
| 4 | … | Q | ||||||||||||
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
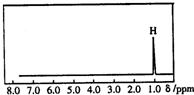 核磁共振是利用在有機物中的1H的原子核所處的“化學環境”(即其附近的基團)不同,表現出的核磁性不同,代表核磁性特征的峰在核磁共振譜圖中橫坐標的位置化學位移,符號為δ)也就不同.如圖所示的核磁共振圖譜表示的是下列有機物中的( )
核磁共振是利用在有機物中的1H的原子核所處的“化學環境”(即其附近的基團)不同,表現出的核磁性不同,代表核磁性特征的峰在核磁共振譜圖中橫坐標的位置化學位移,符號為δ)也就不同.如圖所示的核磁共振圖譜表示的是下列有機物中的( )| A. | CH3C(CH3)3 | B. | CH3CH2CH3 | C. | CH2=CHCH3 | D. | (CH3)2CHCH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向0.1mol•L-1pH=2的HF溶液加水稀釋,$\frac{c({H}^{+})}{c(HF)}$增大 | |
| B. | 向0.2 mol•L-1NaHCO3溶液中加入等體積0.1 mol•L-1NaOH溶液:c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | 濃度均為0.1 mol•L-1的NH3•H2O溶液和NH4Cl溶液等體積混合:c(NH4+)+c(NH3•H2O)=2c(Cl-) | |
| D. | 為確定某酸H2A是強酸還是弱酸,可測NaHA溶液的pH.若pH>7,則H2A是弱酸;若pH<7,則H2A是強酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A | 25℃時,由水電離出來的c(H+)和c(OH-)的乘積為1×10-2 4的某溶液中: Fe2+、NO3-、AlO2-、Na+ | 不能共存 | 發生反應: 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O |
| B | 澄清石灰水中: Ca2+、K+、CH3COO-、HCO3- | 不能共存 | 發生反應: Ca2++OH-+HCO3-=CaCO3↓+H2O |
| C | 常溫常壓下,空氣中: NH3、NO、H2、CO2 | 可以共存 | 不能發生反應 |
| D | 銀氨溶液中: K+、Na+、NO3-、Cl- | 可以共存 | 不能發生反應 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 五種元素的原子半徑從大到小的順序是:M>W>Z>Y>X | |
| B. | 化合物X2W2、YW2、ZW2等都含有極性共價鍵和非極性共價鍵 | |
| C. | 用M單質作陽極,石墨電極作陰極電解NaHCO3溶液,電解一段時后,在陰極區會出現白色沉淀 | |
| D. | X、Z兩元素能形成原子個數比(X:Z)為3:1和2:1的化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙醇與乙酸在濃硫酸加熱條件下反應 | |
| B. | 乙烯通入溴的四氯化碳溶液 | |
| C. | 苯與濃硝酸、濃硫酸的混合物共熱 | |
| D. | 乙醇在銅粉存在下與氧氣反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將廢電池深埋,可防止重金屬污染 | |
| B. | 所有自發進行的化學反應都是放熱反應 | |
| C. | 開發太陽能、風能和氫能等能源代替化石燃料,有利于節約資源、保護環境 | |
| D. | 開發利用可燃冰是緩解能源緊缺的唯一途徑 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com