

分析 (1)水分解得到的可燃氣體為氫氣,則X為氫氣;空氣中能被NaOH吸收的氣體為CO2,則Y為CO2、Z為Na2CO3;CO2與氫氣反應生成甲醇;
(2)①n=2.5時,I中氣體初始物質的量為:2.5 mol+6.5 mol+2 mol+2 mol=13 mol,Ⅱ中氣體的物質的量始終為12 mol,如要是隔板停留在中間,左側反應應向正反應方向移動,以使氣體體積得到12 mol;
要使反應向正方向進行,左側氣體的初始物質的量應大于12 mol,則n mol+10.5 mol>12 mol,同時還要滿足,當CO2或H2完全轉化為產物時,氣體總物質的量應小于12 mol,若CO2完全轉化,生成CH3OH和H2O物質的量均為6.5 mol,已經大于12 mol,故應為氫氣完全轉化時,氣體總物質的量小于12 mol,則6.5 mol-$\frac{1}{3}$n mol+4 mol+$\frac{2}{3}$n mol<12 mol,據此進行計算;
②當n取值3.0和4.0時,反應達平衡時總物質的量不變,反應的轉化率不同,結合反應溫度不同判斷平衡時A的物質的量.
解答 解:(1)水分解得到的可燃氣體為H2,則X為氫氣;空氣中能被NaOH吸收的氣體為CO2,則Y為CO2、Z為Na2CO3,CO2與氫氣反應生成甲醇的反應為:CO2+3H2O=CH3OH+H2O,
故答案為:Na2CO3;CO2+3H2?CH3OH+H2O;
(2)①n=2.5時,I中氣體初始物質的量為:2.5 mol+6.5 mol+2 mol+2 mol=13 mol,Ⅱ中氣體的物質的量始終為12 mol,如要是隔板停留在中間,左側反應應向正反應方向移動,以使氣體體積得到12 mol;
要使反應向正方向進行,左側氣體的初始物質的量應大于12 mol,故:n mol+10.5 mol>12 mol,即n>1.5,同時還要滿足,當CO2或H2完全轉化為產物時,氣體總物質的量應小于12 mol,若CO2完全轉化,生成CH3OH和H2O物質的量均為6.5 mol,已經大于12 mol,故應為氫氣完全轉化時,氣體總物質的量小于12 mol,則有:6.5 mol-$\frac{1}{3}$n mol+4 mol+$\frac{2}{3}$n mol<12 mol,n<4.5,所以n的取值范圍為:1.5<n<4.5,
故答案為:正反應;1.5<n<4.5;
②當n取值3.0和4.0時,反應達平衡時總物質的量均為12 mol時,反應的轉化率不同,反應溫度不同,故平衡時A的物質的量不同,
故答案為:不相等;溫度不同.
點評 本題考查了化學平衡的移動、物質的推斷以及有關基本計算,題目難度中等,明確化學平衡及其影響為解答關鍵,注意掌握討論法在化學計算中的應用,試題培養了學生的分析、理解能力及化學計算能力.


 一諾書業暑假作業快樂假期云南美術出版社系列答案
一諾書業暑假作業快樂假期云南美術出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 分液時,分液漏斗的上層液體應由上口到出 | |
| B. | 向某溶液中加入稀鹽酸,產生的氣體通入澄清石灰水,石灰水變渾濁,該溶液一定是碳酸鹽溶液 | |
| C. | 配置0.1000mol•L-1氫氧化鈉溶液時,將液體轉移到容量瓶中需用玻璃棒引流 | |
| D. | 錐形瓶用作反應容器時可以加熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
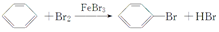 ,
,查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗室中酒精燈著火,立即用水撲滅 | |
| B. | 實驗結束后將所有的廢液倒入下水道排出實驗室,以免污染實驗室 | |
| C. | 皮膚上不慎沾上NaOH溶液,立即用鹽酸沖洗 | |
| D. | 稀釋濃硫酸時,將濃硫酸沿器壁慢慢注入水中,并不斷攪拌 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向沸騰的蒸餾水中滴加飽和FeCl3溶液制備Fe(OH)3膠體:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(膠體)+3H+ | |
| B. | 向碳酸氫鈣溶液中加入過量的氫氧化鈉溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好為中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 稀硝酸和過量的鐵屑反應:Fe+4H++NO3-═Fe3++NO↑+2H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com