
分析 KW=C(H+)•C(OH-)=10-14,KW是只與溫度有關的常數,0.1mol/L 的HA溶液中c(H+)=10-10,溶液中HA中的氫離子未全部電離,說明HA為弱酸,0.01mol/L的BOH溶液pH=12.溶液中氫離子濃度=0.01mol/mol,說明BOH為強堿,
(1)完全電離的電解質為強電解質,部分電離的電解質為弱電解質;
(2)HA為弱酸存在電離平衡;
(3)在加水稀釋HA的過程中,促進HA電離平衡正向進行,平衡狀態下的微粒濃度減小,溶液中存在離子積常數,溫度不變,離子積常數不變;
(4)常溫下pH=12的BOH溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=0.01mol/L,硫酸氫鈉是強酸酸式鹽,其完全電離生成鈉離子、氫離子和硫酸根離子,相當于強酸性溶液,硫酸氫鈉溶液中c(H+)=0.001mol/L,混合溶液pH=11>7,混合溶液中$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=0.001mol/L,則混合溶液呈堿性,混合溶液中c(OH-)=$\frac{0.01mol/L×0.1L-0.001mol/L×VL}{(0.1+V)L}$=0.001mol/L,據此計算V值.
解答 解:KW=C(H+)•C(OH-)=10-14,KW是只與溫度有關的常數,0.1mol/L 的HA溶液中c(H+)=10-10,溶液中HA中的氫離子未全部電離,說明HA為弱酸,0.01mol/L的BOH溶液pH=12.溶液中氫離子濃度=0.01mol/mol,說明BOH為強堿,
(1)上述分析可知,HA為弱酸為弱電解質,BOH是強堿屬于強電解質,故答案為:弱電解質;強電解質;
(2)HA為弱酸存在電離平衡,電離方程式為:HA?H++A-,故答案為:HA?H++A-;
(3)在加水稀釋HA的過程中,促進HA電離平衡正向進行,平衡狀態下的微粒濃度減小,溶液中存在離子積常數,溫度不變,離子積常數不變,
A.加水稀釋促進電離,$\frac{c({H}^{+})}{c(HA)}$之比可以比較物質的量之比,則比值增大,故A正確;
B.加水稀釋促進電離,$\frac{c(HA)}{c({A}^{-})}$之比可以比較物質的量之比,比值減小,故B錯誤;
C.溫度不變,溶液中離子積常數不變,c(H+)與c(OH-)的乘積不變,故C錯誤;
D.加水稀釋,溶液中氫離子濃度減小,c(H+)與c(OH-)的乘積不變,c(OH-)增大,故D正確;
故答案為:AD;
(4)常溫下pH=12的BOH溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=0.01mol/L,硫酸氫鈉是強酸酸式鹽,其完全電離生成鈉離子、氫離子和硫酸根離子,相當于強酸性溶液,硫酸氫鈉溶液中c(H+)=0.01mol/L,混合溶液pH=11>7,混合溶液中$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=0.001mol/L,則混合溶液呈堿性,混合溶液中c(OH-)=$\frac{0.01mol/L×0.1L-0.001mol/L×VL}{(0.1+V)L}$=0.001mol/L,x=450mL,
故答案為:450mL.
點評 本題考查弱電解質的電離、鹽類水解、酸堿混合溶液定性判斷等知識點,為高頻考點,正確判斷電解質強弱是解本題關鍵,難點是混合溶液有關計算,注意:離子積常數只與溫度有關,與溶液酸堿性及濃度無關,題目難度中等.


 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案科目:高中化學 來源: 題型:選擇題
| A. | 用飽和Na2CO3溶液除去CO2中混有的HCl氣體 | |
| B. | 用量筒量取20.83mL12mol/L的濃硫酸配制250mL1mol/L稀硫酸 | |
| C. | 用濃硫酸干燥CO2、SO2、HI等酸性氣體 | |
| D. | 用稀HNO3能鑒別Mg、Na2CO3、NaAlO2、Na2SiO3四種固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗序號 | 反應溫度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCl、HBr、HI的熱穩定性依次增強 | B. | KOH的堿性比NaOH的堿性強 | ||
| C. | HBrO4酸性比HClO4強 | D. | Na的金屬性比Al的弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
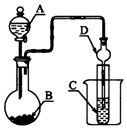
| A. | 若A為濃硫酸,B為Na2SO3固體,C中盛石蕊溶液,則C中溶液先變紅后褪色 | |
| B. | 若A為醋酸溶液,B為貝殼,C中盛過量澄清石灰水,則C中溶液變渾濁 | |
| C. | 若A為濃鹽酸,B為MnO2,C中盛品紅溶液,則C中溶液不褪色 | |
| D. | 若A為濃氨水,B為生石灰,C中盛AlCl3溶液,則C中產生白色沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 能使廣泛pH試紙顯紅色的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 含有大量Al3+的溶液:Na+、Cl-、HCO3-、SO42- | |
| C. | 能使淀粉碘化鉀試紙顯藍色的溶液:K+、SO42-、S2-、SO32- | |
| D. | 常溫下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液:Fe2+、Mg2+、NO3-、Cl- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com