
分析 (1)Cl原子核外電子排布為1s22s22p63s23p5,能層和能級決定電子的能量,電子云不同的伸展方向即為軌道數(shù);
(2)電子層越多半徑越大,同周期元素的原子,從左到右原子半徑逐漸減小,核外電子排布相同的離子,核電荷數(shù)越多半徑越小;
(3)根據(jù)CO2與SiO2形成的晶體類型進行解答,CO2是分子晶體,SiO2是原子晶體,原子晶體的熔點高于分子晶體;
(4)比較兩種元素的非金屬性強弱,可根據(jù)單質之間的置換反應、與氫氣反應的難易程度、氫化物的穩(wěn)定性以及最高正價氧化物對應水化物酸性強弱;
(5)平衡常數(shù)等于生成物濃度的化學計量數(shù)冪之積除以反應物的濃度的化學計量數(shù)冪之積,由于反應③=①+②,故K3=K1×K2,據(jù)此計算;
(6)根據(jù)反應CO(g)+Cl2(g)?COCl2(g)+Q Q>O,可知增加反應物的濃度,平衡正向移動,反應放熱,在絕熱條件,容器內溫度升高,平衡向吸熱方向移動,且平衡常數(shù)發(fā)生改變.
解答 解:(1)Cl原子核外電子排布為1s22s22p63s23p5,有5種不同能級的電子,最外層上的電子云有4種不同的伸展方向,
故答案為:5;4;
(2)P、Cl有三個電子層,C、O有二個電子層,故P、Cl的半徑大于C、O.Cl核電荷數(shù)越多于P,故P半徑大于Cl.O核電荷數(shù)越多于C,故C半徑大于O.即P>Cl>C>O,
故答案為:P>Cl>C>O;
(3)CO2是分子晶體,CO2的熔化與C=O鍵能沒有關系,其熔化只需要克服范德華力(分子間作用力),SiO2是原子晶體,其熔化要破壞Si-O共價鍵,共價鍵的強度遠遠大于范德華力,
故答案為:二氧化碳晶體是分子晶體,二氧化硅是原子晶體,所以后者熔沸點遠高于前者;
(4)a、單質與氫氣化合的難易可用于比較氧的非金屬性比碳的非金屬性強,故不選a;
b、最高價含氧酸的酸性不可用于比較氧和碳非金屬性強弱,因氧無含氧酸,故選b;
c、水的沸點高于甲烷,不可用于比較氧和碳非金屬性強弱,因沸點是物質的物理性質,與化學性質--非金屬性強弱無關,故選c;
d、二者形成的化合物中元素的化合價可用于比較氧的非金屬性比碳的非金屬性強,因CO2中碳顯+4價,氧顯-2價,故不選d.
故答案為:bc;
(5)平衡常數(shù)等于生成物濃度的化學計量數(shù)冪之積除以反應物的濃度的化學計量數(shù)冪之積,由于反應③=①+②,故K3=K1×K2=1×5×104=5×104,
PCl5(g)?PCl3(g)+Cl2(g)
起始濃度(mol/L) 2 0 0
變化濃度(mol/L) x x x
平衡濃度(mol/L) 2-x x x
則:$\frac{{x}^{2}}{2-x}$=1,解得x=1,PCl5(g)的平衡轉化率為$\frac{1mol/L}{2mol/L}$×100%=50%;
C12(g)的平均反應速率為$\frac{1mol/L}{amin}$=$\frac{1}{a}$mol/(L•min);
故答案為:5×104;50%;$\frac{1}{a}$mol/(L•min;
(6)增大反應物的濃度,促進平衡正向移動,即反應向右進行,同時放出大量的熱,在絕熱容器中,溫度升高,平衡逆向移動,平衡常數(shù)K2減小,
故答案為:向右;減小.
點評 本題綜合性較強,考查了原子的核外電子排布規(guī)律、原子半徑的比較、晶體結構分析及平衡常數(shù)的計算與影響因素,難度較大,對培養(yǎng)學生運用知識綜合分析問題、解決問題的能力提高有很大作用.


科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCl、HBr、HI的熱穩(wěn)定性依次增強 | B. | KOH的堿性比NaOH的堿性強 | ||
| C. | HBrO4酸性比HClO4強 | D. | Na的金屬性比Al的弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
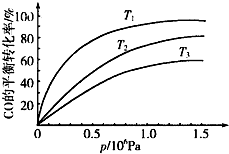 鐵及其化合物在日常生活、生產中應用廣泛,研究鐵及其化合物的應用意義重大.回答下列問題:
鐵及其化合物在日常生活、生產中應用廣泛,研究鐵及其化合物的應用意義重大.回答下列問題:| 溫度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 新的平衡體系中,N2的濃度小于2c mol/L大于c mol/L | |
| B. | 新的平衡體系中,NH3的濃度小于2c mol/L大于c mol/L | |
| C. | 新的平衡體系中,混合氣體的平均摩爾質量小于$\overline{M}$ | |
| D. | 新的平衡體系中,氣體的密度是原平衡體系的1倍 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 三硫化磷(P4S3)是黃綠色針狀晶體,易燃、有毒,分子結構之一如圖所示,已知其燃燒時P被氧化為P4010,下列有關P4S3的說法中不正確的是( )
三硫化磷(P4S3)是黃綠色針狀晶體,易燃、有毒,分子結構之一如圖所示,已知其燃燒時P被氧化為P4010,下列有關P4S3的說法中不正確的是( )| A. | P4S3中磷元素為+3價 | |
| B. | P4S3屬于共價化合物 | |
| C. | P4S3充分燃燒的化學方程式為P4S3+8O2=P4O10+3SO2 | |
| D. | 1 mol P4S3分子中含有9 mol共價鍵 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com