
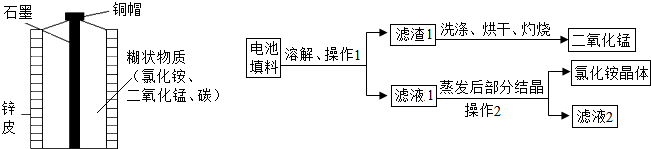
| 實驗序號 | 不同純度的鋅 | 硫酸的質量分數/% | 反應溫度/℃ | 鋅消失的時間/s |
| Ⅰ | 含雜質鋅 | 3 | 20 | 200 |
| Ⅱ | 純鋅 | 3 | 20 | 500 |
| Ⅲ | 純鋅 | 6 | 20 | 300 |
| Ⅳ | 純鋅 | 6 | 30 | 80 |
分析 根據已有的知識進行分析,過濾中玻璃棒起到了引流的作用;蒸發中玻璃棒起到了攪拌、使液體均勻受熱的作用;濾渣1中含有二氧化錳和炭,灼燒是為了除去炭;發生裝置的選擇取決于反應物的狀態和反應的條件;根據實驗提供的數據進行分析比較影響化學反應的速率,據此解答.
解答 解:(1)操作2是蒸發,玻璃棒起到了攪拌、使液體均勻受熱的作用;
(2)過濾得到的濾渣l中含有炭,灼燒能使碳與氧氣反應生成二氧化碳從而除去;
(3)在上述物質中,二氧化錳在實驗室制取氧氣的反應中可用作催化劑,氯化銨含氮元素且可作氮肥;
(4)在某溫度下蒸發濾液1時,首先形成氯化銨的飽和溶液,繼續蒸發,水分減少,氯化銨溶解不了,就結晶析出;
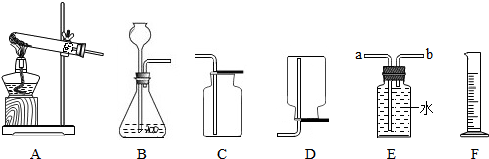
(5)用鋅和稀硫酸制取氫氣.己知氫氣密度比空氣小且難溶于水.
①鋅是固體,稀硫酸是液體,該反應在常溫下可以進行,選擇的發生裝置為B;氫氣的密度比空氣小,要收集比較干燥的氣體,應選用的收集裝置為D;
②若用排水法收集并測定氣體的體積,則需要將E中的水排出,氣體從裝置E導管口b進;選用儀器F測量排出水的體積,儀器F是量筒;若選用50ml的量筒,收集完畢量筒中剩余4ml,則收集的氣體為50-4=46mL;
(6)①比較實驗Ⅰ和實驗Ⅱ,不同的是鋅的純度,可以看出含雜質的鋅消失的時間少,可以得到的結論是含雜質的鋅與稀硫酸反應的快;
②為了研究硫酸濃度對反應快慢的影響,需比較實驗Ⅱ和實驗Ⅲ,故填:Ⅱ,Ⅲ;
③實驗Ⅲ和Ⅳ標明該反應快慢與溫度有關;
④如果把實驗Ⅱ中硫酸的質量分數改為4%,介于3%和6%之間,則鋅消失的時間比3%的硫酸快,比6%的硫酸慢,時間介于200~300之間;
⑤該實驗除了用鋅消失的時間來衡量反應的快慢外,還可用相同的時間內產生的氫氣的體積來衡量該反應的快慢.
故答案為:(1)攪拌、使液體均勻受熱;
(2)除去炭粉;
(3)二氧化錳,氯化銨;
(4)形成了氯化銨的飽和溶液;
(5)①B,D;
②b,量筒,46mL;
(6)①含雜質的鋅與稀硫酸反應的快;
②Ⅱ,Ⅲ;
③溫度;
④200~300;
⑤相同的時間內產生的氫氣的體積來衡量該反應的快慢.
點評 本題考查了物質的分離與提純以及氣體制取和影響化學反應因素的實驗探究,完成此題,可以依據已有的知識結合題干提供的信息進行.


科目:初中化學 來源: 題型:選擇題
| A. | 濾渣中一定有Zn | B. | 濾渣中可能有Ag、Cu | ||
| C. | 濾液中-定有Fe(NO3)2、Zn(NO3)2 | D. | 濾液中可能有AgNO3、Cu(NO3)2 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 分子、原子可以構成物質,所以物質一定是由分子、原子構成的 | |
| B. | 可燃物燃燒時溫度需要達到著火點,所以可燃物的溫度達到著火點一定能燃燒 | |
| C. | 質量守恒定律適用一切化學反應,故紙張燃燒后灰燼質量減少了也符合質量守恒定律 | |
| D. | 堿的溶液pH>7,故pH>7的溶液一定是堿的溶液 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | X>銅>鎘 | B. | 銅>鎘>X | C. | 鎘>X>銅 | D. | 鎘>銅>X |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | +7價 | B. | +6價 | C. | +5價 | D. | +4價 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 丁二酮屬于有機高分子化合物 | |
| B. | 丁二酮中含有氧原子 | |
| C. | 丁二酮中氫元素的質量分數為6.98% | |
| D. | 丁二酮中氧元素的質量分數最大 |
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com