
| 實驗一 | 實驗二 | 實驗三 | 實驗四 | |
| 原固體混合物質量 | 10g | 10g | 10g | 10g |
| 加入CaCl2溶液質量 | 10g | 20g | 30g | 40g |
| 生成的沉淀的質量 | 2g | m | 5g | 5g |
分析 (1)根據實驗數據,加入10gCaCl2溶液完全反應可生成沉淀質量為2g,加入30gCaCl2溶液時仍有沉淀生成,可判斷表中m的值;
(2)加入氯化鈣溶液至完全反應時,生成沉淀質量為5g,根據碳酸鈉與氯化鈣反應的化學方程式,可由生成沉淀碳酸鈣的質量計算中原固體混合物中Na2CO3的質量,根據反應的化學方程式,可以得到各物質之間的比例關系,利用沉淀的質量進而求出氯化鈣的質量,從而求出CaCl2溶液的溶質質量分數.
解答 解:
(1)分析實驗數據可知,每加入10g氯化鈣溶液可生成2g沉淀,因此加入20g氯化鈣溶液時,得到沉淀質量m=2g×$\frac{20g}{10g}$=4g
(2)設10g原固體混合物中Na2CO3質量為x
CaCl2+Na2CO3═CaCO3↓+2NaCl
106 100
x 5g
$\frac{106}{x}$=$\frac{100}{5g}$
x=5.3g
由表中數據可知:10gCaCl2溶液最多生成沉淀質量為2g,設CaCl2的質量為x
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 100
x 2g
$\frac{111}{x}$=$\frac{100}{2g}$
x=2.22g
CaCl2溶液的溶質質量分數=$\frac{2.22g}{10g}$×100%=22.2%
故答案為:(1)4g
(2)5.3g;22.2%
點評 本題主要考查學生對化學方程式的書寫,能夠根據化學方程式判斷現象及生成的物質,熟悉完全反應及不完全反應的概念,并能據此查找數據,進行計算.


科目:初中化學 來源: 題型:解答題
 為了探究堿的性質,甲乙兩組同學向相同體積的石灰水和燒堿溶液中分別通入C02氣體.觀察到前者變渾濁.后者無明顯現象.甲組同學認為C02能與石灰水反應,但不能與燒堿溶液反應.而乙組同學認為C02也能與燒堿溶液發生反應.
為了探究堿的性質,甲乙兩組同學向相同體積的石灰水和燒堿溶液中分別通入C02氣體.觀察到前者變渾濁.后者無明顯現象.甲組同學認為C02能與石灰水反應,但不能與燒堿溶液反應.而乙組同學認為C02也能與燒堿溶液發生反應.查看答案和解析>>
科目:初中化學 來源: 題型:解答題
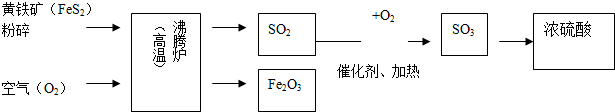
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
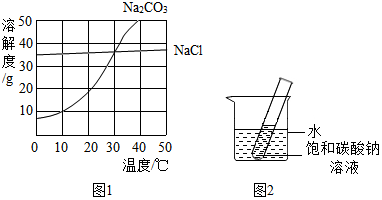
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
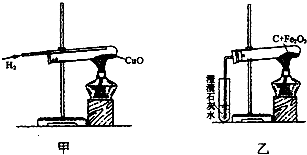 如圖甲是氫氣和氧化銅反應的實驗,圖乙是木炭和氧化鐵反應的實驗.
如圖甲是氫氣和氧化銅反應的實驗,圖乙是木炭和氧化鐵反應的實驗.查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
 圖為硫酸鈉和氯化銨的溶解度曲線.下列說法正確的是( )
圖為硫酸鈉和氯化銨的溶解度曲線.下列說法正確的是( )| A. | 40℃時硫酸鈉的溶解度是50 | |
| B. | 40℃時硫酸鈉飽和溶液的質量分數最大 | |
| C. | 硫酸鈉的溶解度隨著溫度升高而不斷增大 | |
| D. | 降低溫度一定能使硫酸鈉不飽和溶液變成飽和溶液 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
| ③實驗中出現的現象 | 結 論 |
| 產生大量氣泡 | 假設2成立 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 金與銅鋅合金--稀鹽酸 | B. | 硬水與軟水--肥皂水 | ||
| C. | 水與澄清石灰水--二氧化碳氣體 | D. | 氮氣與二氧化碳--燃著的木條 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com