
4.強、弱電解質與物質結構的關系:
強電解質一般為離子化合物和一些含強極性鍵的共價化合物,弱電解質一般為含弱極性鍵的化合物。
3.強、弱電解質與溶液導電性的關系:
溶液的 導電性強弱與溶液中的離子濃度大小有關。強電解質溶液的導電性不一定強,如很稀的強電解質溶液,其離子濃度很小,導電性很弱。而弱電解質溶液的導電性不一定弱,如較濃的弱電解質溶液,其電離出的離子濃度可以較大,導電性可以較強。
導電性強弱與溶液中的離子濃度大小有關。強電解質溶液的導電性不一定強,如很稀的強電解質溶液,其離子濃度很小,導電性很弱。而弱電解質溶液的導電性不一定弱,如較濃的弱電解質溶液,其電離出的離子濃度可以較大,導電性可以較強。
2.強、弱電解質與溶解性的關系:
電解質的強弱取決于電解質在水溶液中是否完全電離,與溶解度的大小無關。一些難溶的電解質,但溶解的部分能全部電離,則仍屬強電解質。如:BaSO4、BaCO3等。
強電解質:在溶液中能夠全部電離的電解質。則強電解質溶液中不存在電離平衡。
弱電解質:在溶液中只是部分電離的電解質。則弱電解質溶液中存在電離平衡。
[注意]
1.強、弱電解質的范圍:
強電解質:強酸、強堿、絕大多數鹽
弱電解質:弱酸、弱堿、水
4.溶劑化作用:電解質溶于水后形成的離子或分子并不是單獨存在的,而是與水分子相互吸引、相互結合,以“水合離子”或“水合分子”的形態存在,這種溶質分子或離子與溶劑相互吸引的作用叫做溶劑作用。
3.常見電解質的范圍:酸、堿、鹽、離子型氧化物。
2.化合物為電解質,其本質是自身能電離出離子,有些物質溶于水時所得溶液也能導電,但這些物質自身不電離,而是生成了一些電解質,則這些物質不屬于電解質。如:SO2、SO3、CO2、NO2等。
電解質:在水溶液里或熔融狀態下能導電的化合物。
非電解質:在水溶液里或熔融狀態下不能導電的化合物。
[注意]
1.電解質和非電解質的范疇都是化合物,所以單質既不是電解質也不是非電解質。
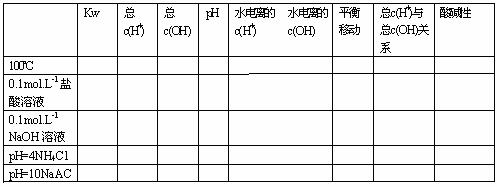
(二)溶液的pH
1、酸性溶液:按C→CH+→pH
2、堿性溶液:按C→COH-→CH+→pH
3、強酸、強堿溶液的稀釋后的溶液:對于酸溶液中的CH+,每稀釋10n倍,pH增大n個單位,但增大后不超過7,酸仍為酸!
①對于堿溶液中的COH-,每稀釋10 n倍,pH減少n個單位,但減少后不小于7,堿仍為堿!
②pH值相同的強酸與弱酸(或強堿與弱堿),稀釋相同的倍數,pH變化為強酸變化大,弱酸變化小。
③極稀溶液中的pH值的計算,應考慮水的電離。
4、強酸與強弱溶液混合的計算: 反應的實質:H++OH-=H2O
三種情況:(1)恰好中和,pH=7 (2)若余酸,先求中和后的CH+,再求pH。 (3)若余堿,先求中和后的COH-,再通過KW求出CH+,最后求pH。
5、已知酸和堿溶液的pH之和,判斷等體積混合后的溶液的p H
(1)若強酸與強堿溶液的pH之和大于14,則混合后顯堿性,pH大于7。
(2)若強酸與強堿溶液的pH之和等于14,則混合后顯中性,pH等于7。
(3)若強酸與強堿溶液的pH之和小于14,則混合后顯酸性,pH小于7。
(4)若酸與堿溶液的pH之和等于14,強、堿中有一強、一弱,則酸、堿溶液混合后,誰弱顯誰性。這是因為酸和堿已電離的H+ 和OH- 恰好中和,誰弱誰的H+ 或OH- 有儲備,中和后還能電離,顯出酸、堿性來。

第1課時 強弱電解質
教材在講述電解質的有關概念時,跨度較大,必修1的第二章第二節講述了電解質的概念,選修《化學反應原理》第三章第一節、第二節講述了強、弱電解質的有關概念。
(一)水的電離

湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com