
23.(12分)中學化學常見的物質A、B、C、D之間存在如下轉化關系:
A + B → C + D + H2O。請按要求填空:
(1)若A為短周期元素組成的黑色固體單質,與B的濃溶液共熱時,產生C、D兩種氣體。C、D兩種氣體均能使澄清石灰水變渾濁,則該反應的化學方程式
是 ,
鑒別這兩種氣體不能選用的試劑是 。
a.BaCl2溶液 b.KMnO4溶液 c.品紅溶液 d.酸化的Ba(NO3)2溶液
向500mL 2mol/L的NaOH 溶液中通入0.8mol無色無味的C氣體,恰好完全反應,該反應的總化學方程式是 ,此時溶液中的離子按照濃度由大到小排列的順序是 。
(2)若A在水中的溶解度隨溫度的升高而降低;B為短周期非金屬單質;D是漂白粉的成分之一。C發生水解反應的離子方程式是 。
(3)若A為五核10電子的陽離子與單核18電子的陰離子構成的無色晶體,受熱易分解,分解后生成兩種極易溶于水的氣體。檢驗A中陰離子的方法是
(簡述操作過程及結論)。
22.(15分)X、Y、Z、W四種物質有如下相互轉化關系(其中X、W單質,Y、Z為化合物,未列出反應條件)。
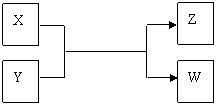
Ⅰ.若Z是生活中常用的調味品,W遇淀粉溶液變藍,則:
(1)常溫下,X的顏色是 。
(2)工業上Z有多種用途,用化學方程式表示Z的一種用途 。
(3)生活中所用的Z加入了碘酸鉀,過量X與Y溶液反應時可以得到一種碘酸鹽,此反應的離子方程式是 。
Ⅱ.下面是某化學課外活動小組研究濃H2SO4的氧化性的結論并進行了實驗驗證:
①一般認為H2SO4濃度大于60%,就具有一定的強氧化性,越濃氧化性越強,60%以下的H2SO4主要體現的是酸性,基本上不體現強氧化性。
②溫度也影響氧化性,如銅放于冷的濃H2SO4中反應不明顯,如果加熱就可以觀察到明顯現象。
 ③98%的濃H2SO4物質的量濃度為18.4
mol/L,密度為1.84 g·cm-3,根據以上信息回答:
③98%的濃H2SO4物質的量濃度為18.4
mol/L,密度為1.84 g·cm-3,根據以上信息回答:
(1)如圖裝置,同學甲先向帶支管的試管中放入銅粉和3 mL水,然后從分液漏斗中加98%的濃H2SO4 0.5 mL,加熱至沸騰,該試管中液體沒有明顯變化,試用數據解釋
原因 。
(2)乙同學利用所示裝置直接從分液漏斗中再加濃H2SO4 10 mL與銅片反應。在左邊試管中所觀察到與甲不同的現象除了有黑色物質出現外,還有
① ,
原因是 。
② ,
原因是 。
21.(11分)用Cl2消毒會使飲用水中的有機物發生氯化,生成有機氯化合物,于人體有害。世界環保聯盟即將全面禁止用氯氣對飲用水消毒。建議推廣采用廣譜性高效消毒劑ClO2氣體。
(1)目前,歐洲一些國家用NaClO3氧化濃鹽酸制取ClO2,同時有Cl2生成,且Cl2體積為ClO2的一半,該反應的化學方程式是: 。
(2)我國最近研究成功用氯氣氧化亞氯酸鈉(NaClO2,N2保護下)制ClO2,其反應的化學方程式為: ,
這一反應的優點是: 。
(3)在H2SO4存在的條件下,用Na2SO3還原NaClO3也可制ClO2,其反應的化學方程式為:
。
23.(10分)已知A、B、C、D、E都是周期表中前四周期的元素,它們的核電荷數A<B<C<D<E。其中A、B、C是同一周期的非金屬元素。化合物DC中存在離子鍵,D的二價陽離子與C的陰離子具有相同的電子層結構。AC2為非極性分子。B、C氫化物的沸點比它們同族相鄰周期元素氫化物的沸點高。E的原子序數為24。請根據以上情況,回答下列問題:(答題時,A、B、C、D、E用所對應的元素符號表示)
(1)A、B、C的第一電離能由小到大的順序為 。
(2)B的氫化物的中心原子采取 雜化。
(3)寫出化合物AC2的電子式 ;一種由B、C組成的化合物與AC2互為等電子體,其化學式為 。
(4)E的核外電子排布式是 。
22. (8分)A、B兩元素在周期表中位于同一周期,核電荷數均小于36,最外層均為一個電子,A的次外層為8個電子,B的電子排布式為1s22s22p63s23p63d104s1(或[Ar] 3d 104s1),則A元素的核外電子排布圖為:____ ;
B的元素符號為_______,位于周期表第_______周期_______族。
21.(4分)把CoCl2溶解于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,生成[Co(NH3)6]2+。此時向溶液中通入空氣,得到的產物中有一種其組成可用CoCl3·5NH3表示。把分離出的CoCl3·5NH3溶于水后立即加硝酸銀溶液,則析出AgCl沉淀。經測定,每1molCoCl3·5NH3只生成2molAgCl。請寫出表示此配合物結構的化學式: ; 此配合物中的Co化合價為 。
20. (6分)元素X的原子最外層電子排布式為nsnnpn+1。原子中能量最高的是
電子;元素X的氫化物的分子結構呈 形;該氫化物可以與H+離子以 鍵相合。
19.(7分)已知周期表中,元素Q、R、W、Y與元素X相鄰。Y的最高化合價氧化物的水化物是強酸,W的氯化物分子呈正四面體結構,W與Q形成高溫陶瓷。這5個元素的氫化物分子中:①立體結構類型相同的氫化物的沸點從高到低排列次序是(填化學式) ,其原因是 ;
②(3分)電子總數相同的氫化物的化學式和立體結構分別是
。
18. (4分) 1919年,Langmuir提出等電子原理:原子數相同、電子總數相同的微粒,互稱為等電子體。等電子體的結構相似、物理性質相近。
(1)根據上述原理,僅由第2周期元素組成的共價分子中,互為等電子體的是: 和 。(任意寫出一組即可)
(2)此后,等電子原理又有所發展。例如,由短周期元素組成的微粒,只要其原子數相同,各原子最外層電子數之和相同,也可互稱為等電子體,它們也具有相似的結構特征。在短周期元素組成的物質中,與NO2-互為等電子體的分子有: 。(任意寫出一個即可)
17.(8分)已知元素的某種性質“X”和原子半徑、金屬性、非金屬性等一樣,也是元素的一種基本性質。下面給出13種元素的X的數值:
|
元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
|
X數值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
|
元素 |
Mg |
Na |
O |
P |
S |
Si |
|
|
X數值 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
|
試結合元素周期律知識完成下列問題:
(1)經驗規律:當形成化學鍵的兩原子相應元素的X差值大于1.7時,所形成的一般為離子鍵;當小于1.7時,一般為共價鍵。試推斷AlBr3中的化學鍵類型是______。
(2)根據上表給出的數據,簡述主族元素的X的數值大小與元素的金屬性或非金屬性強弱之間的關系_________________________ ;
簡述第二周期元素(除惰性氣體外)的X的數值大小與原子半徑之間的關系__________________________________________ 。
(3)某化合物分子中含有S-N鍵,該共用電子對偏向于________原子(填元素符號)。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com