
題目列表(包括答案和解析)
25.(11分)I.高爐煉鐵中發生的基本反應之一是FeO(s)+CO(g)⇋Fe(s)+CO2(g) ΔH>0。其平衡常數可表達為k =c(CO2)/c(CO),已知1100℃時,k=0.263。
(1)溫度升高,平衡移動后達到新的平衡,高爐內CO2和CO的體積比值 (填“增大”“減小”或“不變”),平衡常數k值 (填“增大”“減小”或“不變”)。
 (2)1100℃時測得高爐中c(CO2)=0.025mol∙L-1,c(CO)=0.1mol∙L-1,在這種情況下,該反應是否處于平衡狀態
(填“是”或“否”)。此時,化學反應速率是v(正) v(逆)(填“>”“<”或“=”),原因是
(2)1100℃時測得高爐中c(CO2)=0.025mol∙L-1,c(CO)=0.1mol∙L-1,在這種情況下,該反應是否處于平衡狀態
(填“是”或“否”)。此時,化學反應速率是v(正) v(逆)(填“>”“<”或“=”),原因是
II.如圖所示,溫度不變時,把某容器分割成A、B兩部分,A容器體積固定不變,B有可移動的活塞,現在A中充入2 mol SO2和1 mol O2,在B中充入2 mol SO3和 1 mol N2,在相同條件下發生可逆反應:2 SO2(g)+O2(g)  2 SO3(g)。根據下列要求填寫空白:
2 SO3(g)。根據下列要求填寫空白:
(1)固定活塞位置在3處不動,達到平衡時,設A中壓強為PA , B中壓強為PB,則PA與PB的關系是PA _____ PB(填“<”、“=”、“>”)。
(2)若要使A與B中平衡狀態相同,可移動活塞的位置應在 處。
③若活塞右移到5處,達到平衡后,B中SO3為x mol,
A中SO3為y mol , 則x和y 的關系是x y. (填“<”、“=”、“>”)。
24. (7分)已知甲、乙、丙分別代表中學化學中的常見物質,請根據題目要求回答下列問題:
(1). 若甲的化學式為RCl3,其溶液在加熱蒸干并灼燒時可發生反應:
a.甲+H2O 乙+丙 b.乙
乙+丙 b.乙 氧化物+H2O
氧化物+H2O
①若甲為某用途廣泛的金屬元素的氯化物,其溶液在上述變化中生成的氧化物為紅棕色粉末,則該金屬在周期表中的位置是: 第四周期,第Ⅷ族 。
②若甲為某短周期金屬元素的氯化物,則甲發生a反應的化學方程式為:
AlCl+3HOAl(OH)↓+3HCl↑ 。
③將以上兩種金屬單質用導線連接,插入一個盛有NaOH溶液的燒杯中構成原電池,則負極發生的電極反應為_Al-3e-+4OH-===AlO-+2HO 。
(2)若甲,乙、丙均是短周期中同一周期元素形成的單質或化合物,常溫下乙為固體單質,甲和丙均為氣態化合物,且可發生反應:甲+乙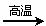 丙。則:
丙。則:
①甲的結構式為O==C==O。
②寫出上述反應的化學方程式O+C2CO 。
③寫出在200mL 2mol/L的NaOH溶液中通入6.72L(標準狀況)的氣體甲發生完全反應的總離子方程式_3CO+4OH-===2HCO-+CO2-+HO(2分,寫為其它形式的均不給分)
23.(13分)為測定碳酸鈣純度(設含雜質SiO2),同學們設計了如下幾個實驗方案,請回答每個方案中的問題。
[方案I](1)稱取碳酸鈣樣品 M g;(2)加入過量鹽酸;(3)收集并測定生成的氣體體積 V mL。
問題:如果稱量樣品時,砝碼底部有一處未被實驗者發現的殘缺,那么測定的碳酸鈣的純度會 (偏高、偏低、無影響)
[方案II](1)稱取碳酸鈣樣品
M g;(2)用c mol/L 鹽酸 V mL(過量)溶解樣品;(3)取溶解后的溶液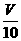 mL,用c/ mol/L NaOH溶液滴定,恰好用去V′mL。
mL,用c/ mol/L NaOH溶液滴定,恰好用去V′mL。
問題1:列出本實驗中所用到的儀器名稱(除鐵架臺及附件、燒杯之外)
。
問題2:加鹽酸后是否需要濾出SiO2后再用NaOH滴定 (填選項編號)。
A.需要 B.不需要 C.均可
[方案III](1)稱取碳酸鈣樣品 M g;(2)把樣品高溫(1000℃)煅燒直至質量不再發生變化,冷卻后稱量,質量為M/ g。
問題1:為什么要煅燒至1000℃且“直至質量不再改變”? ;
問題2:本方案中的“冷卻”應如何操作 。
[方案IV](1)稱取碳酸鈣樣品 M g;(2)加入足量c mol/L鹽酸V mL使之完全溶解;(3)過濾并取濾液;(4)在濾液中加入過量c′mol/L Na2CO3溶液V′mL;(5)將步驟(4)中的沉淀濾出、洗滌、干燥、稱重為M/ g。
問題1:此方案中不需要的數據是 (填選項編號)。
A.c、V B.c′、 V′ C. M′ D. M
問題2:為減少實驗誤差,必要的操作是 (填選項編號)。
A.精確測定Na2CO3溶液體積V′mL
B.精確配制濃度c′mol/L Na2CO3溶液
C.將步驟(3)所得沉淀洗滌,洗滌液也應并入(4)中
D.將步驟(3)所得沉淀洗滌、干燥、稱量其質量M′g備用
問題3:步驟(5)中要將沉淀進行洗滌,如果未經洗滌,則測定的碳酸鈣純度
將 (偏高、偏低、無影響)。
綜上所述,你認為4個方案中,最好的方案是 ,其它方案的缺點分別是:
方案IV:沉淀的洗滌、干燥、稱量操作過程復雜,容易造成較大誤差;
方案 ; 。
方案 ; 。
22.(12分) 學習了元素周期律后,同學們對第四周期過渡元素氧化物產生了濃厚的興趣。是否只有二氧化錳能催化氯酸鉀受熱分解?氧化鐵、氧化銅、氧化鉻等對氯酸鉀的受熱分解有沒有催化作用?對此他們進行了實驗探究。請你根據要求完成下列部分實驗報告。
I 課題名稱:____________________________________________________________
II實驗儀器及試劑:實驗儀器:帶鐵夾的鐵架臺、帶橡皮塞的導管、量氣裝置、過濾裝置、電子天平、藥匙、________、________、________等。
實驗試劑:二氧化錳、氧化鐵、氧化銅、氧化鉻和氯酸鉀
III 實驗步驟:略
IV 實驗數據:
|
實驗 編號 |
KClO3(g) |
氧化物 |
產生氣體(mL) |
耗時(s) |
||
|
化學式 |
質量(g) |
回收 |
(已折算為標況) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
異常 |
67.2 |
188.3 |
V 實驗討論:(1)在氧化物的回收過程中,要進行過濾操作,所用的玻璃儀器是玻璃棒、_________、________
(2)實驗編號3的實驗中KClO3的分解率為_________%(保留一位小數)
(3) 在用Cr2O3 做研究實驗時,發現有刺激性氣味的氣體產生,同時綠色的混合物變成了橘黃色。該刺激性氣體是________(填分子式),可用______________試紙檢驗。上述異常現象產生的原因是___________________________________。
VI 實驗結論:_____________________________________________________________
21.(7分)某中學有甲、乙兩個探究性學習小組,他們擬用一定質量的純鋁片與足量稀硫酸的反應測定通常狀況(約20℃,101kPa)下氣體摩爾體積的方法。
(1)甲組同學擬選用下列實驗裝置完成實驗:
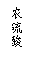

①該組同學必須選用的裝置的連接順序是A接( )( )接( )( )接( )(填接口字母,可不填滿。)
②實驗開始時,先打開分液漏斗上口的玻璃塞,再輕輕打開其活塞,一會兒后稀硫酸也不能順利滴入錐形瓶。請你幫助分析原因。 。
③實驗結束時,該組同學應怎樣測量實驗中生成氫氣的體積?
___________________________________________________________________________。
 (2)乙組同學仔細分析甲組同學的實驗裝置后,認為:稀硫酸滴入錐形瓶中,即使不生成氫氣,也會將瓶內空氣排出,使所測氫氣體積偏大;實驗結束時,連接廣口瓶和量筒的導管中有少量水存在,使所測氫氣體積偏小。于是他們設計了如右圖所示的實驗裝置。
(2)乙組同學仔細分析甲組同學的實驗裝置后,認為:稀硫酸滴入錐形瓶中,即使不生成氫氣,也會將瓶內空氣排出,使所測氫氣體積偏大;實驗結束時,連接廣口瓶和量筒的導管中有少量水存在,使所測氫氣體積偏小。于是他們設計了如右圖所示的實驗裝置。
裝置中導管a的作用是 ______________________ ,
_______________________________________________________ _。
20、已知反應2A(g)+B(g) 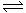 2C(g) △H<0;若甲為恒溫恒壓容器,乙為恒溫恒容容器,初始時兩容器的溫度、體積相同。如果向甲容器中充入2mol A、1mol B ,向乙容器中充入a mol C,一段時間后兩容器中反應均達到平衡,且兩容器中A在平衡混合氣中的物質的量分數相同,則下列說法可能正確的是:
2C(g) △H<0;若甲為恒溫恒壓容器,乙為恒溫恒容容器,初始時兩容器的溫度、體積相同。如果向甲容器中充入2mol A、1mol B ,向乙容器中充入a mol C,一段時間后兩容器中反應均達到平衡,且兩容器中A在平衡混合氣中的物質的量分數相同,則下列說法可能正確的是:
A、a < 2 B、a =2 ,并增大甲的壓強
C、a > 2 D、a = 2 ,并降低乙的溫度
19.以兩塊質量相同的銅板為電極,電解足量的AgNO3溶液,一段時間后,溶液質量減少了7.6g,則下列說法中正確的是:
A、電解過程共轉移了0.05mol電子 B、陽極質量減少,陰極質量增加
C、兩電極的質量差為14g D、兩電極的質量差為7.6g
18.下列有關化學實驗的操作或說法中,正確的是
A.用有少量蒸餾水的錐形瓶裝待測液進行中和滴定實驗,對測定結果沒有影響
B.在進行硫酸銅晶體里結晶水含量的測定實驗中,稱量操作至少要進行3次
C.苯酚中滴加少量稀溴水一定能出現三溴苯酚白色沉淀
D.檢驗溴乙烷中的溴元素時,將溴乙烷和氫氧化鈉溶液混合加熱后,需加硫酸酸化
17.我國化學家侯德榜根據NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性質,運用CO2 + NH3 + H2O + NaCl = NaHCO3↓+ NH4Cl的反應原理制備純堿。下面是在實驗室進行模擬實驗的生產流程示意圖:

則下列敘述錯誤的是:
A.A氣體是CO2,B氣體是NH3
B.第Ⅲ步得到的晶體是發酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃儀器是燒杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要過程有溶解、蒸發、結晶
16.下列論述中,正確的的是
A、某蓄電池的總反應式為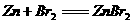 ,則充電時,陽極上發生的反應為
,則充電時,陽極上發生的反應為
2Br-- 2e- == Br2
B、用標準鹽酸滴定未知濃度 溶液,滴定前仰視讀數,滴定后俯視讀數,會使計算結果偏低
溶液,滴定前仰視讀數,滴定后俯視讀數,會使計算結果偏低
C、工業硫酸生產吸收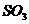 時,
時,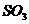 從吸收塔底部通入,水從塔頂噴下,剩余氣體從塔上部放出
從吸收塔底部通入,水從塔頂噴下,剩余氣體從塔上部放出
D、新型無機非金屬材料雖然克服了傳統無機材料的缺點,但強度比較差
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com